Médico especialista do artigo
Novas publicações
Síndrome de hiperestimulação ovárica
Última revisão: 05.07.2025

Todo o conteúdo do iLive é medicamente revisado ou verificado pelos fatos para garantir o máximo de precisão factual possível.
Temos diretrizes rigorosas de fornecimento e vinculamos apenas sites de mídia respeitáveis, instituições de pesquisa acadêmica e, sempre que possível, estudos médicos revisados por pares. Observe que os números entre parênteses ([1], [2], etc.) são links clicáveis para esses estudos.
Se você achar que algum dos nossos conteúdos é impreciso, desatualizado ou questionável, selecione-o e pressione Ctrl + Enter.
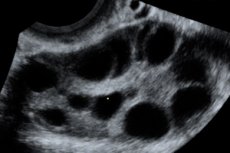
A síndrome de hiperestimulação ovariana (SHO) é uma complicação iatrogênica baseada na resposta hiperérgica descontrolada dos ovários à administração de gonadotrofinas em ciclos de estimulação da ovulação e programas de tecnologia de reprodução assistida.
A síndrome pode se manifestar após a indução da ovulação com clomifeno ou no início da gravidez em um ciclo espontâneo.
 [ 1 ]
[ 1 ]
Epidemiologia
A incidência da síndrome de hiperestimulação ovariana varia de 0,5 a 14% com diferentes esquemas de estimulação da ovulação e não tende a diminuir. A doença apresenta graus variados de gravidade e pode ser fatal devido ao desenvolvimento de complicações tromboembólicas ou SDRA. A taxa de mortalidade esperada é de 1 em 450-500 mil mulheres. Formas graves da síndrome, que requerem hospitalização em unidade de terapia intensiva, ocorrem em 0,2 a 10%. De acordo com o Registro Nacional Russo de Métodos de Tecnologia de Reprodução Assistida, a incidência de SHO grave em 2004 foi de 5,6%.
Causas da Síndrome de Hiperestimulação Ovariana
Fatores de risco para o desenvolvimento da síndrome de hiperestimulação ovariana:
- idade inferior a 35 anos,
- físico astênico,
- a presença de ovários policísticos ou multifoliculares,
- maturação de mais de dez folículos no protocolo de estimulação da ovulação,
- uso de medicamentos agonistas do hormônio liberador de gonadotrofina e altas doses de gonadotrofinas,
- o início da gravidez,
- suporte da fase lútea com preparações de hCG,
- doenças alérgicas.
Como se desenvolve a síndrome de hiperestimulação ovariana?
A síndrome de hiperestimulação ovariana ocorre em um contexto de concentração anormalmente alta de hormônios sexuais no plasma sanguíneo, afetando negativamente as funções de vários sistemas do corpo, principalmente os ovários, e é caracterizada por um aumento no tamanho dos ovários, às vezes até 20-25 cm de diâmetro, com a formação de cistos foliculares e luteínicos, em meio a um edema estromal pronunciado. O gatilho para o desenvolvimento da síndrome é a introdução de uma dose ovulatória de gonadotrofina coriônica. O desenvolvimento da síndrome baseia-se no fenômeno de "aumento da permeabilidade vascular", levando a uma liberação maciça de fluido rico em proteínas no terceiro espaço, o interstício, e sua deposição com o desenvolvimento de hipovolemia, hemoconcentração, oligúria, hipoproteinemia, desequilíbrio eletrolítico, aumento da atividade das enzimas hepáticas, formação de ascite, hidrotórax e hidropericárdio, com ou sem choque hipovolêmico. No entanto, o "fator X" que causa a transudação de fluidos permanece desconhecido. Em casos graves, ocorrem anasarca, insuficiência renal aguda, complicações tromboembólicas e SDRA.
Atualmente, a síndrome de hiperestimulação ovariana é considerada do ponto de vista da SIRS, em cujo contexto ocorre dano maciço ao endotélio. Em pacientes com SHO, altas concentrações de interleucinas (IL-1, IL-2, IL-6, IL-8), fatores de necrose tumoral (TNF-a, TNF-(3)), que aumentam a síntese de prostaglandinas pelos ovários, neovascularização ovariana e permeabilidade vascular, foram encontradas no transudato peritoneal. Sob a influência de citocinas pró-inflamatórias, ocorre ativação sistêmica dos processos de coagulação. A magnitude da leucocitose se correlaciona com a gravidade da SIRS. O dano órgão-sistêmico na SHO é semelhante ao dano que ocorre na sepse. O papel do fator microbiano na SHO e sua contribuição para o desenvolvimento da SIRS está atualmente em discussão. Supõe-se que microrganismos que colonizam os intestinos e o trato geniturinário podem penetrar além de seu habitat e ter um efeito no corpo semelhante ao da sepse.
Sintomas da síndrome de hiperestimulação ovariana
A gravidade da síndrome está diretamente relacionada à gravidade dos distúrbios hemodinâmicos que causam o quadro clínico. O início da síndrome pode ser gradual, com aumento dos sintomas, ou súbito (agudo), com redistribuição acentuada de fluidos no corpo em poucas horas, com acúmulo nas cavidades serosas. Quando a síndrome se manifesta, surgem queixas de fraqueza, tontura, dor de cabeça, tremores de "moscas" diante dos olhos, falta de ar em repouso e durante esforços físicos, tosse seca que se intensifica na posição deitada, boca seca, náuseas, vômitos, diarreia, distensão abdominal, sensação de distensão, tensão, dor abdominal frequentemente sem localização clara, micção rara, febre, inchaço da genitália externa e dos membros inferiores.
Em pacientes com síndrome de hiperestimulação ovariana, pode ocorrer insuficiência respiratória devido à mobilidade pulmonar limitada devido à ascite, aumento ovariano ou derrame pleural. O curso da SHO grave na fase de manifestação pode ser complicado por hidrotórax agudo, SDRA, embolia pulmonar, embolia pulmonar, atelectasia e hemorragia intra-alveolar. Derrame pleural é diagnosticado em aproximadamente 70% das mulheres com SHO moderada a grave, e o derrame pode ser unilateral ou bilateral e ocorrer em contexto de ascite. Na SHO, foram descritos deslocamento e compressão dos órgãos mediastinais devido a derrame pleural direito maciço com desenvolvimento de choque, bem como um desfecho fatal em uma mulher com SHO e hidrotórax devido a atelectasia e hemorragia maciça no lúmen alveolar.
Distúrbios hemodinâmicos. Na SHO moderada e grave, ocorrem hipotensão arterial e taquicardia.
Ascite. O abdômen fica distendido, frequentemente tenso, doloroso em todas as áreas, mas mais frequentemente no hipogástrio, na projeção dos ovários.
Disfunção renal e hepática. Observam-se retenção urinária, oligúria, anúria e hepatomegalia.
O curso da SHO em 80% dos pacientes com uma forma grave da síndrome é acompanhado por febre. Em 20% das mulheres, a febre ocorre no contexto de uma infecção do trato urinário, em 3,8% - devido a pneumonia, em 3,3% - uma infecção do trato respiratório superior. Tromboflebite devido à instalação de um cateter intravenoso causa febre em 2%, inflamação da gordura subcutânea no local da punção da parede abdominal durante a laparocentese - em 1% dos pacientes. Infecção da ferida operatória ocorre em 1% e abscessos pós-injeção (administração intramuscular de progesterona) em 0,5%. Febre de gênese não infecciosa em cada segundo paciente com SHO provavelmente está associada a mecanismos pirogênicos endógenos. Casos isolados de sepse em SHO grave foram descritos.
No contexto do desenvolvimento da síndrome, ocorre uma exacerbação de doenças somáticas crônicas latentes.
O que está incomodando você?
Classificação
Não existe uma classificação única para a síndrome de hiperestimulação ovariana. Com base nos sintomas clínicos e laboratoriais, distinguem-se quatro graus de gravidade da síndrome:
- SHO leve. Desconforto abdominal, ovários de até 8 cm de diâmetro, com ou sem cistos, parâmetros laboratoriais normais. A SHO leve é chamada de "hiperestimulação ovariana controlada", pois essa condição é observada em absolutamente todos os ciclos de estimulação da superovulação e atualmente não é considerada uma síndrome patológica que necessite de tratamento.
- SHO moderada. Dor moderada em todas as partes do abdômen, náuseas, vômitos, diarreia, ovários de 8 a 12 cm de diâmetro com cistos, sinais ultrassonográficos e/ou clínicos de ascite, hematócrito não superior a 45%, leucocitose - 10-16x10 9 /l, hipercoagulabilidade (dímero D - superior a 0,5 μg/ml, concentração de fibrinogênio - superior a 400 mg/dl, TTPA, INR - dentro dos limites normais).
- SHO grave. Hematócrito acima de 45%, leucocitose 17-24x10 9 /l, hipercoagulação (dímero D acima de 5 μg/ml, fibrinogênio acima de 600 mg/dl), ovários com mais de 12 cm de diâmetro e cistos, todos os sinais clínicos e laboratoriais de SHO moderada e ascite tensa, hidrotórax, disfunção hepática, oligúria [diurese menor que 0,5 ml/(kg h)].
- SHO crítica. Hematócrito acima de 55%, leucocitose acima de 25x109/l, ascite tensa, hidrotórax bilateral, hidropericárdio, anasarca, ovários aumentados até 20-25 cm, oligúria ou anúria, insuficiência renal aguda, complicações tromboembólicas, SDRA.
A síndrome de hiperestimulação ovariana também é dividida em precoce e tardia.
Se a SHO ocorrer na fase lútea e a implantação não ocorrer, a síndrome desaparece repentina e espontaneamente com o início da menstruação, raramente atingindo uma forma grave. Se ocorrer implantação, na maioria das vezes observa-se uma piora na condição da paciente durante as primeiras 12 semanas de gravidez. A SHO tardia é causada por um aumento significativo de hCG no plasma sanguíneo e geralmente está associada à implantação e ao início da gravidez.
Consequências e complicações
Complicações da síndrome de hiperestimulação ovariana podem ocorrer com o desenvolvimento de complicações tromboembólicas. A causa da trombose na SHO permanece desconhecida, mas o papel principal na patogênese dessa condição é atribuído a altas concentrações de hormônios sexuais, citocinas pró-inflamatórias, hemoconcentração e diminuição da VCP. Longos períodos de hospitalização, atividade motora limitada, diminuição do retorno venoso devido ao aumento dos ovários, aumento da atividade dos fatores de coagulação, inibidores de fibrinólise e plaquetas contribuem adicionalmente para o alto risco de desenvolvimento de complicações trombóticas associadas à SHO. Foi demonstrado que em 84% das pacientes com complicações tromboembólicas que surgiram após a indução da ovulação e em programas de tecnologia de reprodução assistida, seu desenvolvimento ocorreu durante a gravidez. Em 75% dos casos, observou-se formação de trombo no leito venoso com localização predominante nos vasos das extremidades superiores, pescoço e cabeça (60%). Várias pacientes foram diagnosticadas com trombose arterial espontânea localizada nos vasos cerebrais. Menos frequentemente, trombos foram observados nas artérias femoral, poplítea, carótida, subclávia, ilíaca, ulnar, mesentérica e na aorta. A literatura apresenta uma observação do desenvolvimento de oclusão da artéria central da retina com perda de visão na SHEO. A incidência de embolia pulmonar em pacientes com SHEO e trombose venosa profunda de membros inferiores é de 29%, enquanto em mulheres com SHEO e trombose venosa profunda de membros superiores e trombose arterial, o risco dessa complicação é significativamente menor, de 4% e 8%, respectivamente.
Casos graves de síndrome de hiperestimulação ovariana podem ser acompanhados de complicações que requerem intervenção cirúrgica - ruptura de um cisto ovariano e sangramento intra-abdominal, torção dos apêndices uterinos, gravidez ectópica.
Diagnóstico da síndrome de hiperestimulação ovariana
O diagnóstico da síndrome de hiperestimulação ovariana é estabelecido com base em dados de anamnese, exame clínico, laboratorial e instrumental completo que revela ovários aumentados com múltiplos cistos, hemoconcentração acentuada e hipercoagulação em uma paciente que utilizou tecnologias de reprodução assistida ou indução controlada da ovulação neste ciclo para obter a gravidez.
Pesquisa de laboratório
Exame de sangue clínico
Hematócrito acima de 40%, concentração de hemoglobina acima de 140 g/l, leucocitose até 50x10 9 /l sem desvio à esquerda, trombocitose até 500-600x10 6 /l. Hemoconcentração (hematócrito acima de 55%) indica risco potencial de vida.
Exame bioquímico de sangue
Desequilíbrio eletrolítico, incluindo hipercalemia (acima de 5,3 mmol/l) e hiponatremia (acima de 135 mmol/l), levando à diminuição da osmolaridade plasmática. Hipoproteinemia (proteína total acima de 66 g/l), hipoalbuminemia (albumina abaixo de 35 g/l), proteína C-reativa elevada, aumento das transaminases hepáticas até 800 U/l, em alguns casos, aumento da GGT ou da fosfatase alcalina, em alguns pacientes - aumento da concentração de creatinina acima de 80 μmol/l e de ureia acima de 8,3 mmol/l.
 [ 20 ], [ 21 ], [ 22 ], [ 23 ]
[ 20 ], [ 21 ], [ 22 ], [ 23 ]
Coagulograma
Aumento dos níveis de fibrinogênio acima de 400 mg/dL, fator de von Willebrand acima de 140%, diminuição das concentrações de antitrombina III abaixo de 80%, dímero D acima de 0,5 mcg/ml. Valores normais de TTPA, IPT e INR.
 [ 24 ]
[ 24 ]
Imunoglobulinas sanguíneas
Diminuição da concentração de IgG e IgA no plasma sanguíneo. Análise geral da urina. Proteinúria.
Análise da composição do líquido ascítico
Alto teor de proteína (mais de 42 g/l) e albumina (mais de 23 g/l), baixa contagem de glóbulos brancos, contagem relativamente alta de glóbulos vermelhos, altas concentrações de todas as citocinas pró-inflamatórias, proteína C-reativa de até 135 mg/l (normal 0-8,2 mg/l), fração globulina das proteínas.
 [ 25 ], [ 26 ], [ 27 ], [ 28 ], [ 29 ], [ 30 ], [ 31 ]
[ 25 ], [ 26 ], [ 27 ], [ 28 ], [ 29 ], [ 30 ], [ 31 ]
Marcadores tumorais no plasma sanguíneo
A concentração de CA-125, refletindo a proliferação maciça de tecido ovariano, atinge seus valores máximos (até 5125 U/ml) na segunda semana de desenvolvimento da SHO, quando ambos os ovários estão mais dilatados. O nível elevado do marcador tumoral persiste por até 15 a 23 semanas após o aparecimento dos sinais da síndrome de hiperestimulação ovariana, apesar do tratamento.
A procalcitonina no soro sanguíneo é determinada em 50% dos pacientes na faixa de 0,5-2,0 ng/ml, o que é considerado uma reação inflamatória sistêmica moderada.
Pesquisa microbiológica
Ao examinar a urina secretada pela vagina e pelo canal cervical, patógenos atípicos Pseudomonas, Proteus, Klebsiella, Enterobacter, E. coli são isolados em quantidades de mais de 10.000 UFC/ml.
Pesquisa instrumental
Ultrassonografia dos órgãos pélvicos
Ovários aumentados de 6 a 25 cm de diâmetro com múltiplos cistos, útero de tamanho normal ou aumentado, presença de líquido livre na cavidade pélvica e gestação única ou múltipla progressiva normal.
Ultrassonografia de órgãos abdominais
Presença de líquido livre na cavidade abdominal em quantidade de 1 a 5-6 litros. Tamanho e estrutura do fígado normais ou hepatomegalia. Ecossinais de discinesia biliar. Ao exame dos rins, o complexo calipélvico está inalterado.
Ultrassonografia das cavidades pleurais
Presença de líquido livre no Ecocardiograma. No contexto de distúrbios hemodinâmicos, diminuição da FE, diminuição do volume diastólico final, diminuição do retorno venoso e, em alguns casos, presença de líquido livre na cavidade pericárdica.
ECG
Distúrbios do ritmo, como extrassístole ventricular, taquicardia, alterações metabólicas e eletrolíticas difusas no miocárdio. Radiografia de tórax. Realizada se houver suspeita de SDRA e tromboembolia. Um achado radiográfico característico na SDRA é o aparecimento de um padrão em "vidro fosco" e infiltrados multifocais difusos de densidade relativamente alta (consolidação) com brônquios aéreos bem definidos, ou seja, o desenvolvimento de extensa lesão do parênquima pulmonar. Na embolia pulmonar, a radiografia revela uma posição alta da cúpula diafragmática, atelectasia discoide, pletora de uma das raízes pulmonares ou uma raiz "cortada", depleção do padrão pulmonar sobre a área isquêmica do pulmão e uma sombra triangular periférica de inflamação.
Indicações para consulta com outros especialistas
Devido ao envolvimento de todos os órgãos e sistemas no processo patológico, a avaliação por um terapeuta é obrigatória. Se houver suspeita de complicações trombóticas, é necessária uma consulta com um cirurgião vascular. Na presença de hidrotórax pronunciado, é necessária uma consulta com um cirurgião torácico para decidir sobre a realização de uma punção pleural.
O que precisa examinar?
Como examinar?
Quais testes são necessários?
Tratamento da síndrome de hiperestimulação ovariana
A ausência de um conceito claro da fisiopatologia da SHO torna impossível realizar um tratamento eficaz e patogeneticamente fundamentado que permita interromper de forma eficaz e rápida o desenvolvimento da síndrome e dos distúrbios de múltiplos órgãos que acompanham as formas graves da síndrome de hiperestimulação ovariana. Atualmente, não há terapia específica para a síndrome de hiperestimulação ovariana, portanto, as medidas de tratamento para essas pacientes são reduzidas à terapia patogênica até a regressão espontânea da síndrome, à medida que a concentração de hCG no plasma sanguíneo diminui ao longo de 7 dias em ciclos onde a gravidez não ocorreu, ou 10-20 dias quando a gravidez ocorreu. A maioria das pacientes hospitalizadas em unidades de terapia intensiva já é admitida com diagnóstico de SHO após tratamento ambulatorial, que consiste em avaliação diária do peso e da diurese, limitação da atividade física excessiva e da atividade sexual, ingestão abundante de líquidos com adição de soluções ricas em eletrólitos e exames de sangue periódicos. A discussão da estratégia de tratamento para esse grupo de pacientes envolve tratamento sintomático abrangente com o objetivo de prevenir o desenvolvimento de PRF restaurando o CCP, eliminando hemoconcentração, desequilíbrio eletrolítico, prevenindo insuficiência renal aguda, SDRA e complicações tromboembólicas.
Etapa 1 - avaliação da gravidade da condição
O primeiro passo para determinar as táticas de tratamento de uma paciente com síndrome de hiperestimulação ovariana é avaliar a hemodinâmica e a função respiratória. Também é necessário realizar um exame físico completo com um estudo aprofundado da condição dos membros, cabeça e pescoço para excluir trombose venosa profunda e instalar um cateter venoso periférico ou cateterismo venoso central. O cateterismo da veia subclávia é o mais apropriado, pois o risco de trombose neste caso é o menor. O cateterismo vesical é necessário para avaliar a diurese. É necessário examinar os parâmetros clínicos dos exames de sangue, eletrólitos plasmáticos, proteínas, atividade das enzimas hepáticas, creatinina, níveis de ureia e parâmetros do coagulograma diariamente. A ultrassonografia abdominal é realizada para determinar o grau de aumento ovariano e a presença de ascite.
Estágio 2 - terapia de infusão
A terapia medicamentosa de pacientes com SHO deve ter como objetivo manter a hemodinâmica e mobilizar o fluido contido na cavidade abdominal, criando um balanço hídrico e de sódio negativo. O objetivo principal é repor o volume de fluido circulante para reduzir a hemoconcentração e manter a filtração renal adequada. Soluções cristaloides e coloides são utilizadas na terapia de infusão da síndrome de hiperestimulação ovariana.
A escolha da solução cristaloide é determinada pelo desequilíbrio eletrolítico. Ao determinar a quantidade de cristaloides administrados, é necessário levar em consideração que, em condições de dano endotelial generalizado, o volume dessas soluções deve ser 2 a 3 vezes menor que o volume das soluções coloides, uma vez que a predominância de cristaloides agrava o acúmulo de líquido nas cavidades serosas e, em alguns casos, leva ao desenvolvimento de anasarca.
O fármaco de escolha para a restauração e manutenção do volume intravascular em pacientes com SHO é o hidroxietilamido 130/0,42, com volume diário de 25-30 ml/kg. O hidroxietilamido 200/0,5 também pode ser utilizado na terapia básica da SHO na dose de 20 ml/(kg x dia). No entanto, pode acumular-se no organismo e, com o uso prolongado, causar disfunção hepática e aumento dos níveis de transaminases hepáticas, por vezes até 800 U/l. Nesse grupo de pacientes, o uso de hidroxietilamido 450/0,7 é inadequado devido ao alto risco de reações alérgicas, impacto negativo na função renal e hepática e deterioração dos parâmetros de hemocoagulação (prolongamento do tempo de coagulação sanguínea, risco de complicações hemorrágicas). As indicações para o uso de soluções de dextrana são limitadas pela alta frequência de reações alérgicas, impacto negativo no sistema de hemostasia, liberação do fator de von Willebrand, indução da cascata pró-inflamatória e ausência de impacto nas propriedades reológicas do sangue nas doses utilizadas. A infusão de dextranas em condições de aumento da permeabilidade capilar pode levar ao desenvolvimento da chamada síndrome de dextrana, acompanhada de lombalgia, comprometimento da função hepática e renal e desenvolvimento de coagulopatia. Soluções de gelatina também não são indicadas para terapia de infusão em SHEO.
Em caso de hipoproteinemia inferior a 25 g/l, utiliza-se solução de albumina a 20%, com volume diário de 3 ml/kg. Recomenda-se o uso exclusivo de solução de albumina a 20%, visto que a pressão oncótica de uma solução a 20% é de cerca de 100 mmHg, e a pressão oncótica de uma solução a 5% é de cerca de 20 mmHg. Em condições de alta permeabilidade do endotélio vascular, a infusão de solução de albumina a 5%, em contraste com a de 20%, leva a uma troca mais intensa com o reservatório extravascular e a um aumento acentuado da pressão oncótica no interstício, o que leva a um aumento da hiperidratação intersticial pulmonar.
Diuréticos são indicados em casos de oligúria e edema periférico, com hematócrito atingindo valores de 36-38%. A prescrição prematura ou excessiva de diuréticos pode provocar agravamento da hipovolemia e da hemoconcentração, aumentando o risco de complicações trombóticas. A furosemida é a mais utilizada - 20-40 mg uma vez por via intramuscular ou intravenosa lenta durante 1-2 minutos.
Princípios da terapia de infusão para síndrome de hiperestimulação ovariana
Após a administração da dose inicial de soluções cristaloides e coloides, o volume da terapia de infusão adicional é determinado levando-se em consideração os seguintes parâmetros: diurese - menos de 1 ml/(kg h), hematócrito - menos de - 40%, pressão arterial média - mais de 70 mm Hg, pressão venosa central - 8-10 mm H2O. Quando os parâmetros especificados forem atingidos, a terapia de infusão é interrompida. É aconselhável administrar o volume diário total de soluções de infusão em frações ao longo do dia. O não cumprimento dessas abordagens resulta no desenvolvimento de hemodiluição, que provoca rápido acúmulo de líquido nas cavidades serosas e deterioração da condição da paciente. Um erro típico no tratamento de mulheres com SHO é o prolongamento injustificado da terapia de infusão quando os parâmetros hemodinâmicos se normalizam e uma tentativa de interromper completamente o desenvolvimento de SHO como uma condição iatrogênica.
Etapa 3 - prevenção de complicações
Prevenção de trombose e tromboembolismo
A base para a prevenção de complicações trombóticas na síndrome de hiperestimulação ovariana é a eliminação da hemoconcentração. A terapia antitrombótica é indicada quando surgem sinais laboratoriais de hipercoagulação. A HBPM é usada para isso:
- nadroparina cálcica (dose diária - 100 UI anti-Xa/kg 2 vezes por via subcutânea),
- dalteparina sódica (100-150 UI anti-Xa/kg 2 vezes por via subcutânea),
- enoxaparina sódica (1 ml/kg/dia) 1-2 vezes por via subcutânea).
Monitorização laboratorial - determinação da atividade anti-Xa plasmática 3 horas após a administração de HBPM, o que permite manter uma dose eficaz do medicamento dentro da faixa terapêutica segura, minimizando assim a probabilidade de sangramento. Os medicamentos antitrombóticos são mantidos até que os parâmetros de coagulação sanguínea estejam normalizados. A monitorização é realizada pela determinação da concentração de dímero D no plasma por método quantitativo. A duração da administração de HBPM é determinada individualmente e, em alguns casos, pode exceder 30 dias.
Prevenção de complicações infecciosas
Considerando o efeito positivo da prescrição de preparações de imunoglobulina na prevenção de infecções secundárias em outras doenças acompanhadas de perda de proteína, pode-se esperar a eficácia dessa terapia em pacientes com SHO. No entanto, para a confirmação ou refutação final dessa hipótese do ponto de vista da medicina baseada em evidências, é necessário conduzir estudos. Atualmente, a indicação para terapia antibacteriana empírica é o risco de infecção secundária em pacientes em estado crítico ou com hemodinâmica instável. O medicamento selecionado empiricamente é alterado com base nos resultados dos testes bacteriológicos. Ao prescrever terapia antibacteriana empírica, é necessário ser guiado por informações sobre a gravidade da doença, fatores de risco para infecção e as características de resistência a antibióticos em uma determinada UTI.
Suporte nutricional
É administrado por via oral a todos os pacientes com SHO grave e crítica. É necessário seguir as recomendações:
- valor energético 25-35 kcal/(kgxdia),
- glicose - menos de 6 g/(kg x dia),
- lipídios - 0,5-1 g/(kg x dia),
- proteínas - 1,2-2 g/(kg x dia),
- conjunto diário padrão de microelementos e vitaminas.
Etapa 4 - métodos cirúrgicos
Indicações para laparocentese em mulheres com síndrome de hiperestimulação ovariana:
- ascite tensa progressiva,
- oligúria inferior a 0,5 ml/dkg/min),
- um aumento na concentração de creatinina acima de 80 μmol/l ou uma diminuição na sua depuração,
- hemoconcentração com valor de hematócrito superior a 40%, não passível de correção medicamentosa.
O acesso transabdominal ou transvaginal pode ser selecionado para laparocentese. Ovários aumentados criam dificuldades técnicas, razão pela qual o uso de controle ultrassonográfico é extremamente importante. A drenagem a longo prazo da cavidade abdominal (laparocentese transabdominal) de 14 a 30 dias com remoção parcial do transudato peritoneal com cateter apirogênico CystoFix® apresenta uma série de vantagens, pois permite evitar a evacuação única de um grande volume de transudato peritoneal e, assim, eliminar flutuações bruscas na pressão intra-abdominal que causam distúrbios hemodinâmicos, estabilizando a condição da paciente e evitando punções repetidas da cavidade abdominal para remoção do líquido ascítico nessa categoria de pacientes. O volume total de líquido ascítico evacuado durante o tratamento da SHO grave pode variar de 30 a 90 litros.
Em pacientes com hidrotórax e síndrome de hiperestimulação ovariana, justifica-se uma abordagem expectante. Quando o hidrotórax se forma, a punção da cavidade pleural é realizada apenas em caso de insuficiência respiratória progressiva grave.
Critérios para início de suporte respiratório na síndrome de hiperestimulação ovariana grave e crítica:
- ausência de respiração espontânea e ritmos respiratórios patológicos,
- diminuição do índice respiratório para menos de 200 mm Hg,
- arritmias cardíacas com risco de vida,
- taquicardia persistente acima de 120,
- hipotensão grave,
- taquipneia acima de 40,
- envolvimento dos músculos respiratórios acessórios.
No caso de desenvolvimento de SDRA e transferência para ventilação mecânica, utiliza-se:
- pequenos volumes respiratórios (6 ml/kg),
- pressão inspiratória <30 cm H2O,
- PEEP (>10 cm H2O),
- A manobra de recrutamento alveolar é utilizada.
O tratamento cirúrgico para a síndrome de hiperestimulação ovariana justifica-se apenas na presença de patologia aguda de torção do apêndice, ruptura do cisto ovariano e sangramento do cisto ovariano. Em caso de torção ovariana, a destorção laparoscópica do ovário é mais eficaz. Um erro típico na estratégia de tratamento para pacientes com SHO sem complicações é a cirurgia de emergência e ressecção de cerca de 30 a 50% do tecido ovariano ou ooforectomia bilateral.

