Médico especialista do artigo
Novas publicações
Medicamentos
Neurolépticos ou antipsicóticos
Última revisão: 04.07.2025

Todo o conteúdo do iLive é medicamente revisado ou verificado pelos fatos para garantir o máximo de precisão factual possível.
Temos diretrizes rigorosas de fornecimento e vinculamos apenas sites de mídia respeitáveis, instituições de pesquisa acadêmica e, sempre que possível, estudos médicos revisados por pares. Observe que os números entre parênteses ([1], [2], etc.) são links clicáveis para esses estudos.
Se você achar que algum dos nossos conteúdos é impreciso, desatualizado ou questionável, selecione-o e pressione Ctrl + Enter.
Os antipsicóticos (neurolépticos) são uma classe de medicamentos psicotrópicos usados principalmente para tratar a esquizofrenia. Atualmente, é comum distinguir dois grupos (ou categorias) de medicamentos: antipsicóticos típicos e atípicos. Abaixo, você encontrará informações sobre as propriedades farmacológicas, indicações de uso e efeitos colaterais da terapia para cada um desses grupos de medicamentos.
Indicações para o uso de antipsicóticos típicos
Atualmente, as principais indicações para prescrição de neurolépticos tradicionais, de acordo com recomendações fornecidas por pesquisadores renomados na área de psicofarmacoterapia, incluem as seguintes.
- Alívio da agitação psicomotora e dos distúrbios comportamentais causados por sintomas psicóticos graves. Nesses casos, está indicado o uso de medicamentos orais ou parenterais com ação antipsicótica, tanto globais (clopromazina, levomepromazina, tioproperazina, zuclopentixol) quanto seletivos, atuando nos transtornos alucinatório-paranoides (haloperidol, trifluoperazina).
- Terapia antirrecaída (preventiva). Para esse fim, são prescritas formas de depósito de medicamentos, especialmente em pacientes com baixa adesão ao tratamento (decanoato de haloperidol, forma prolongada de flupentixol), ou doses pequenas ou médias de medicamentos para obter um efeito desinibitório (antinegativo), dentre aqueles cujas altas doses são usadas para aliviar transtornos psicóticos agudos (flupentixol, zuclopentixol). Nesse tipo de terapia, também é recomendada a prescrição dos chamados neurolépticos de baixa potência (tioridazina, clorprotixeno, sulpirida), cuja atividade psicotrópica consiste em um efeito sobre as manifestações do polo depressivo e distúrbios insônicos.
- Superação da resistência terapêutica aos antipsicóticos atípicos no tratamento de estados psicóticos agudos. Para tanto, são geralmente utilizadas formas parenterais de antipsicóticos tradicionais com ação antipsicótica global (clorpromazina, levomepromazina, etc.) e seletiva (haloperidol).
Esses medicamentos causam vários efeitos colaterais, cuja natureza depende das características do perfil farmacológico de cada medicamento. Antipsicóticos com efeito colinolítico mais pronunciado causam com mais frequência distúrbios de acomodação, constipação, boca seca e retenção urinária. Um efeito sedativo é mais típico de antipsicóticos com efeito anti-histamínico pronunciado, e a hipotensão ortostática é mais típica de medicamentos que bloqueiam os receptores α1-adrenérgicos. O bloqueio da transmissão colinérgica, nordrenérgica e dopaminérgica por neurolépticos típicos pode levar a uma série de distúrbios na esfera sexual, como amenorreia ou dismenorreia, anorgasmia, galactorreia, inchaço e dor nas glândulas mamárias e diminuição da potência. Os efeitos colaterais na esfera sexual estão associados principalmente às propriedades colinolíticas e adrenobloqueadoras desses medicamentos, e também ao aumento da secreção de prolactina devido ao bloqueio do metabolismo da dopamina. Os efeitos colaterais mais graves dos neurolépticos típicos são a disfunção motora. São o motivo mais comum para os pacientes interromperem o uso de medicamentos. Os três principais efeitos colaterais da terapia associados à influência na esfera motora incluem síndromes extrapiramidais precoces, discinesia tardia e SNM.
Acredita-se que as síndromes extrapiramidais estejam associadas ao bloqueio dos receptores D2 nos gânglios da base. Elas incluem distonia, parkinsonismo neuroléptico e acatisia. Manifestações de reação distônica aguda (discinesia precoce) incluem hipercinesia de desenvolvimento súbito, crises oculogíricas, contrações dos músculos da face e do tronco e opistótono. Esses distúrbios são dose-dependentes e frequentemente ocorrem após 2 a 5 dias de terapia com neurolépticos altamente potentes, como haloperidol e flufenazina. Para aliviar a discinesia precoce, a dose de neuroléptico é reduzida e medicamentos anticolinérgicos (biperideno, triexifenidil) são prescritos. A discinesia tardia geralmente envolve os músculos do pescoço e, diferentemente da reação distônica aguda, é menos responsiva ao tratamento com anticolinérgicos. O parkinsonismo neuroléptico é caracterizado por diminuição das habilidades motoras espontâneas, hipo e amimia, tremor em repouso e rigidez. É importante distinguir esses sintomas dos transtornos negativos aparentemente semelhantes da esquizofrenia, que são representados por alienação emocional, embotamento afetivo e anergia. Para corrigir esses efeitos colaterais, indica-se o uso de anticolinérgicos, a redução da dose do neuroléptico ou sua substituição por um antipsicótico atípico. A acatisia se manifesta por ansiedade interna, incapacidade de permanecer em um lugar por muito tempo e necessidade de movimentar constantemente os braços ou as pernas. Para aliviá-la, utilizam-se anticolinérgicos e betabloqueadores centrais (propranolol).
A discinesia tardia manifesta-se por movimentos involuntários de qualquer grupo muscular, mais frequentemente os músculos da língua e da boca. Clinicamente, distinguem-se várias formas: discinesia dos músculos das bochechas, língua e boca (contrações periódicas dos músculos mastigatórios, criando a impressão de uma pessoa a fazer caretas; a língua pode projetar-se involuntariamente para fora da boca do paciente); distonia tardia e acatisia tardia (o paciente realiza movimentos coreoatetoides da cabeça, tronco e membros superiores e inferiores). Esta forma de distúrbio é registada principalmente durante o tratamento a longo prazo com neurolépticos tradicionais e é detetada em aproximadamente 15-20% dos pacientes que os tomam como terapia de manutenção. Provavelmente, em alguns pacientes, o risco de desenvolver sintomas de discinesia é aumentado, visto que alguns deles foram observados na clínica da esquizofrenia mesmo antes da "era neuroléptica". Além disso, a discinesia tardia tem sido descrita em mulheres idosas e em pacientes com perturbações afetivas. Acredita-se que a discinesia tardia esteja associada a um aumento no número de receptores de dopamina no estriado, embora os sistemas GABAérgico e outros neurotransmissores também possam estar envolvidos em sua patogênese. Não existe um tratamento universal eficaz para esses efeitos colaterais. Sugere-se que baixas doses de neurolépticos de alta potência com ação bloqueadora de dopamina ou vitamina E podem ter um efeito benéfico moderado nesses distúrbios. A medida mais eficaz para a discinesia tardia é a redução da dose de um neuroléptico típico ou sua substituição por um antipsicótico atípico.
De acordo com dados atuais, a síndrome neuroléptica maligna ocorre em aproximadamente 0,5% dos casos de psicofarmacoterapia. Provavelmente, a rara ocorrência de uma complicação tão fatal pode ser explicada atualmente pela ampla introdução de antipsicóticos atípicos na prática, uma vez que o risco de desenvolver SNM durante o tratamento com esses medicamentos é insignificante. É geralmente aceito que a principal causa do desenvolvimento de SNM é o bloqueio excessivo do sistema dopaminérgico durante a terapia com neurolépticos, especialmente após o aumento da dose de um antipsicótico altamente potente. Os principais sintomas da SNM são hipertermia, aumento do tônus dos músculos esqueléticos e reflexos tendinosos, comprometimento da consciência com transição para o coma. Os exames de sangue revelam leucocitose, aumento da velocidade de hemossedimentação, atividade das transaminases hepáticas; os exames de urina revelam a presença de albuminúria. Distúrbios do equilíbrio hídrico e eletrolítico ocorrem rapidamente, o que cria os pré-requisitos para a formação de edema cerebral. A SNM é uma condição aguda que requer hospitalização urgente do paciente para terapia de infusão intensiva. No tratamento da SNM, a hidratação e a terapia sintomática são de suma importância. Nessa situação, qualquer neuroléptico prescrito requer descontinuação imediata. Em alguns casos, agonistas dos receptores dopaminérgicos (por exemplo, bromocriptina) ou relaxantes musculares apresentam efeito positivo, embora sua eficácia não tenha sido estudada. Após a interrupção da SNM, o neuroléptico não deve ser retomado por pelo menos duas semanas. Posteriormente, um antipsicótico de baixa potência pode ser prescrito, de preferência um medicamento de nova geração. A dose do novo medicamento prescrito deve ser aumentada com extremo cuidado, monitorando-se o estado das funções vitais e os dados laboratoriais (exames de sangue e urina).
Neurolépticos típicos raramente causam complicações fatais perigosas. As manifestações de superdosagem estão principalmente relacionadas ao perfil individual da ação antiadrenérgica e anticolinérgica do fármaco. Como esses fármacos têm forte efeito antiemético, a lavagem gástrica é indicada para sua eliminação do organismo, em vez da administração de eméticos. A hipotensão arterial, via de regra, é consequência do bloqueio dos receptores adrenérgicos e deve ser corrigida com a administração de dopamina e norepinefrina. Em caso de arritmia cardíaca, o uso de lidocaína é indicado.
Mecanismo de ação e efeitos farmacológicos dos antipsicóticos típicos
Com o desenvolvimento da psicofarmacologia, diversas opções para o efeito dos antipsicóticos sobre os neurorreceptores foram propostas. A principal hipótese continua sendo a de que eles afetam as neuroestruturas da dopamina (principalmente os receptores D2), com base em dados sobre a interrupção do metabolismo normal da dopamina em estruturas cerebrais em psicoses. Os receptores D2 da dopamina estão localizados nos gânglios da base, no núcleo accumbens e no córtex frontal; desempenham um papel fundamental na regulação do fluxo de informações entre o córtex cerebral e o tálamo.
A figura demonstra uma compreensão mais detalhada dos distúrbios na transmissão de dopamina nas áreas corticais e subcorticais do cérebro e o papel desses distúrbios no desenvolvimento dos sintomas da esquizofrenia (adaptado da monografia de Jones RB, Buckley PF, 2006).
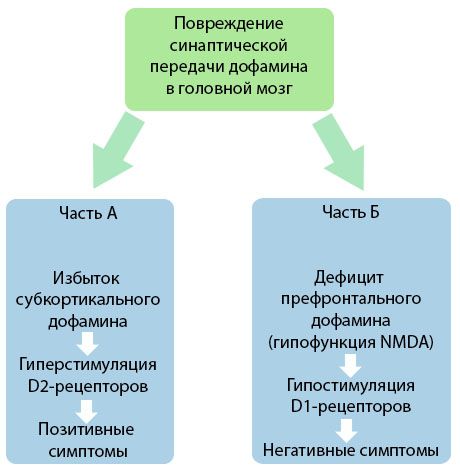
A Parte A reflete a teoria clássica e inicial da dopamina, postulando um excesso de dopamina em áreas subcorticais e uma hiperestimulação dos receptores D2, o que leva ao surgimento de sintomas produtivos. A Parte B demonstra a subsequente modernização da teoria no início da década de 1990. Os dados obtidos até então revelaram que uma deficiência de dopamina nos receptores D, juntamente com a estimulação insuficiente desses receptores no córtex pré-frontal, leva ao surgimento de sintomas negativos e déficits cognitivos. Portanto, de acordo com a compreensão moderna, ambos os tipos de distúrbios da transmissão dopaminérgica — um excesso de dopamina subcortical e sua deficiência no córtex pré-frontal — são o resultado combinado de uma interrupção da transmissão sináptica na área pré-frontal e estão associados à hipofunção do N-metil-N-aspartato. Além da dopamina inicialmente isolada, outros neurotransmissores envolvidos na patogênese da esquizofrenia foram posteriormente identificados, como a serotonina, o ácido gama-aminobutírico, o glutamato, a norepinefrina, a acetilcolina e diversos neuropeptídeos. Embora o papel desses mediadores não tenha sido totalmente estudado, com o avanço do conhecimento, torna-se claro que a manifestação de inúmeras alterações neuroquímicas no corpo é evidente. Portanto, o efeito clínico de um antipsicótico é uma soma dos efeitos sobre diversas formações de receptores e leva à eliminação de distúrbios da homeostase.
Nos últimos anos, devido ao surgimento de novos métodos de pesquisa, como a ligação de ligantes radioisotópicos e a tomografia por emissão de pósitrons (PET), houve um progresso significativo na elucidação do mecanismo bioquímico de ação dos neurolépticos. Em particular, foram determinados a força e o tropismo comparativos de fármacos para se ligarem a neurorreceptores individuais em diversas áreas e estruturas do cérebro. Foi demonstrada uma dependência direta da gravidade do efeito antipsicótico de um fármaco em relação à força de seu efeito bloqueador sobre diversos receptores dopaminérgicos. Recentemente, quatro tipos desses receptores foram identificados:
- D1 estão localizados predominantemente na área da substância negra e do estriado (a chamada região nigroestriatal), bem como na região pré-frontal;
- D2 - nas regiões nigroestriatal, mesolímbica e hipófise anterior (secreção de prolactina);
- D3 (pré-sináptico) - em várias estruturas cerebrais, controla a atividade dopaminérgica de acordo com a lei do feedback negativo;
- D4 (pré-sináptico) - predominantemente nas áreas nigroestriatal e mesolímbica.
Ao mesmo tempo, pode-se agora considerar comprovado que é o bloqueio dos receptores D2 que causa o desenvolvimento de efeitos antipsicóticos, sedativos secundários e efeitos colaterais extrapiramidais. Outras manifestações clínicas do bloqueio desse tipo de receptor são o efeito analgésico e antiemético dos neurolépticos (redução de náuseas e vômitos como resultado da supressão do centro do vômito), bem como a diminuição do hormônio do crescimento e o aumento da produção de prolactina (efeitos colaterais neuroendócrinos, incluindo galactorreia e irregularidades menstruais). O bloqueio prolongado dos receptores D2 nigroestriatais leva ao aparecimento de sua hipersensibilidade, responsável pelo desenvolvimento de discinesias tardias e "psicoses de hipersensibilidade". As prováveis manifestações clínicas do bloqueio dos receptores pré-sinápticos D3 e D4 estão associadas principalmente ao efeito estimulante dos neurolépticos. Devido ao bloqueio parcial desses receptores nas áreas nigroestriatal e mesolimbocortical, neurolépticos ativadores e incisivos (potentes, altamente ativos) em pequenas doses podem estimular, e em altas doses suprimir, a transmissão dopaminérgica.
Nos últimos anos, o interesse pela função dos sistemas serotoninérgicos do cérebro, incluindo os receptores de serotonina, aumentou acentuadamente. O fato é que, em várias partes do cérebro, o sistema serotoninérgico tem um efeito modulador sobre as estruturas dopaminérgicas. Em particular, na região mesocortical, a serotonina inibe a liberação de dopamina e, consequentemente, o bloqueio dos receptores 5-HT pós-sinápticos leva a um aumento no conteúdo de dopamina. Como se sabe, o desenvolvimento de sintomas negativos na esquizofrenia está associado à hipofunção dos neurônios dopaminérgicos nas estruturas pré-frontais do córtex cerebral. Atualmente, são conhecidos cerca de 15 tipos de receptores 5-HT centrais. Foi descoberto experimentalmente que os neurolépticos se ligam principalmente aos receptores 5-HT dos três primeiros tipos.
Esses medicamentos têm um efeito principalmente estimulante (agonístico) sobre os receptores 5-HT1a. Possíveis consequências clínicas: aumento da atividade antipsicótica, redução da gravidade dos distúrbios cognitivos, correção dos sintomas negativos, efeito antidepressivo e redução da incidência de efeitos colaterais extrapiramidais.
O efeito dos neurolépticos nos receptores 5-HT2, especialmente nos subtipos 5-HT2a, é de significativa importância. Eles estão localizados principalmente no córtex cerebral e sua sensibilidade é aumentada em pacientes com esquizofrenia. A capacidade dos neurolépticos de nova geração de reduzir a gravidade dos sintomas negativos, melhorar as funções cognitivas, regular o sono aumentando a duração total dos estágios de sono de ondas lentas (onda D), reduzir a agressividade e aliviar os sintomas depressivos e as cefaleias semelhantes à enxaqueca (decorrentes de distúrbios cerebrovasculares) está associada ao bloqueio dos receptores 5-HT2a. Por outro lado, com o bloqueio dos receptores 5-HT2a, são possíveis efeitos hipotensivos e distúrbios ejaculatórios em homens.
Acredita-se que o efeito dos neurolépticos nos receptores 5-HT2c cause um efeito sedativo (ansiolítico), aumento do apetite (acompanhado de aumento do peso corporal) e diminuição da produção de prolactina.
Os receptores 5-HT3 estão localizados predominantemente na região límbica e, quando são bloqueados, o efeito antiemético se desenvolve primeiro, e os efeitos antipsicóticos e ansiolíticos também são potencializados.
A ocorrência de sintomas semelhantes aos do parkinsonismo também depende do poder de bloqueio do fármaco sobre os receptores colinérgicos muscarínicos. Os efeitos colinolíticos e bloqueadores da dopamina estão, até certo ponto, em relações recíprocas. Sabe-se, por exemplo, que na região nigroestriatal os receptores D2 inibem a liberação de acetilcolina. Quando mais de 75% dos receptores D2 na região nigroestriatal são bloqueados, o equilíbrio é perturbado em favor do sistema colinérgico. Esta é a razão para o efeito corretivo dos fármacos anticolinérgicos (corretores) sobre os efeitos colaterais extrapiramidais dos neurolépticos. Clorprotixeno, clozapina e olanzapina têm alta afinidade pelos receptores muscarínicos e praticamente não causam efeitos colaterais extrapiramidais, uma vez que bloqueiam os receptores colinérgicos e dopaminérgicos simultaneamente. Os derivados de haloperidol e piperazina fenotiazina têm um efeito pronunciado sobre os receptores de dopamina, mas têm um efeito muito fraco sobre os receptores de colina. Isso se deve à sua capacidade de causar efeitos colaterais extrapiramidais pronunciados, que são reduzidos com o uso de doses muito altas, quando o efeito colinolítico se torna perceptível. Além de reduzir o efeito bloqueador da dopamina nos receptores D2 da região nigroestriatal e nivelar os efeitos colaterais extrapiramidais, um forte efeito colinérgico pode causar deterioração das funções cognitivas, incluindo distúrbios de memória, bem como efeitos colaterais periféricos (mucosas secas, acomodação visual prejudicada, constipação, retenção urinária, confusão, etc.). Os neurolépticos têm um efeito bloqueador bastante forte nos receptores de histamina tipo I, o que está associado, em primeiro lugar, à gravidade do efeito sedativo, bem como ao aumento do peso corporal devido ao aumento do apetite. Os efeitos antialérgicos e antipruriginosos dos neurolépticos também estão associados às suas propriedades anti-histamínicas.
Além dos efeitos bloqueadores da dopamina, antiserotonérgicos, colinolíticos e anti-histamínicos, a maioria dos neurolépticos possui propriedades adrenolíticas, ou seja, bloqueiam os receptores α1-adrenérgicos centrais e periféricos. Adrenobloqueadores, como clorpromazina e clorprotixeno, têm um efeito sedativo pronunciado. Além disso, o efeito bloqueador desses medicamentos pode causar efeitos colaterais neurovegetativos (hipotensão arterial, taquicardia, etc.), bem como um aumento do efeito hipotensor dos adrenobloqueadores.
Os trabalhos de um grande número de autores fornecem dados sobre a força de ligação (afinidade) de neurolépticos individuais com diferentes tipos de neurorreceptores.
Com base em seu perfil neuroquímico de ação, os antipsicóticos típicos e atípicos, entre aqueles predominantemente usados na prática clínica, podem ser condicionalmente divididos em seis grupos.
O primeiro grupo consiste em bloqueadores seletivos dos receptores D2 e D4 (sulpirida, amisudprida, haloperidol, etc.) dos grupos de derivados de benzamida e butirofenona. Em pequenas doses, principalmente devido ao bloqueio dos receptores D4 pré-sinápticos, eles ativam a transmissão dopaminérgica dos impulsos nervosos e têm um efeito estimulante (desinibitório); em altas doses, bloqueiam os receptores D2 em todas as áreas do cérebro, o que se manifesta clinicamente por um efeito antipsicótico pronunciado, bem como por efeitos colaterais extrapiramidais e endócrinos (devido à prolactinemia).
O segundo grupo inclui bloqueadores dos receptores D2 altamente ativos, bem como fármacos que bloqueiam fraca ou moderadamente os receptores 5-HT2a e 5-HT1a (flupentixol, flufenazina, zuclopentixol, etc.), ou seja, principalmente derivados piperazínicos de fenotiazinas ou tioxantenos com estrutura estereoquímica próxima a eles. Assim como os fármacos do primeiro grupo, esses neurolépticos têm, em primeiro lugar, um efeito antipsicótico (incisivo) pronunciado e também causam efeitos piramidais extrapiramidais e prolactinemia. Em pequenas doses, têm um efeito moderadamente ativador (psicoestimulante).
O terceiro grupo consiste em neurolépticos sedativos polivalentes que bloqueiam a maioria dos neurorreceptores de forma indiferenciada. Esses fármacos têm um efeito bloqueador claramente expresso nos receptores de dopamina e também causam fortes efeitos adrenolíticos e colinolíticos. Isso inclui a maioria dos neurolépticos sedativos, principalmente derivados alifáticos e piperidínicos da fenotiazina, bem como tioxantenos que são próximos a eles em estrutura estereoquímica (clorpromazina, levomepromazina, clorprotixeno, etc.). O espectro de atividade psicotrópica desses fármacos é dominado, em primeiro lugar, por um efeito sedativo primário pronunciado, que se desenvolve independentemente da dose utilizada, e um efeito antipsicótico moderado. Além disso, devido ao seu pronunciado efeito anticolinérgico, os fármacos desse grupo causam efeitos colaterais extrapiramidais e neuroendócrinos fracos ou moderados, mas frequentemente levam ao desenvolvimento de hipotensão ortostática e outras reações autonômicas devido ao bloqueio pronunciado dos receptores α1-adrenérgicos.
O quarto grupo inclui neurolépticos que bloqueiam os receptores D2 e 5-HT2a de forma equilibrada, ou seja, na mesma extensão (este último em uma extensão ligeiramente maior) e os receptores adrenérgicos a1 em extensão moderada. Este grupo inclui representantes da nova geração de antipsicóticos atípicos (risperidona, ziprasidona, sertindol), que possuem diferentes estruturas químicas. O mecanismo de ação neuroquímico determina sua influência seletiva principalmente nas áreas mesolímbica e mesocortical do cérebro. Juntamente com um efeito antipsicótico distinto, a ausência ou fraca expressão de efeitos colaterais extrapiramidais (ao usar doses terapêuticas), prolactinemia fraca ou moderada e propriedades adrenolíticas moderadas (reações hipotensivas), este grupo de neurolépticos é capaz de corrigir sintomas negativos por estimulação indireta da transmissão dopaminérgica no córtex cerebral.
O quinto grupo consiste em antipsicóticos atípicos polivalentes de dibenzodiazepínicos tricíclicos ou estrutura similar (clozapina, olanzapina e quetiapina). Assim como os fármacos do terceiro grupo, eles bloqueiam a maioria dos neurorreceptores de forma indiferenciada. No entanto, os receptores 5-HT2a são bloqueados mais fortemente do que os receptores D2 e D4, especialmente aqueles localizados na região nigroestriatal. Isso determina a ausência real ou fraco efeito extrapiramidal e a ausência de efeitos colaterais neuroendócrinos associados ao aumento da produção de prolactina com um efeito antipsicótico distinto e a capacidade de reduzir a gravidade dos sintomas negativos. Além disso, todos os fármacos deste grupo têm propriedades adrenolíticas e anti-histamínicas pronunciadas, o que determina os efeitos sedativos e hipotensores. A clozapina e a olanzapina também têm um efeito bloqueador bastante pronunciado sobre os receptores muscarínicos e levam ao desenvolvimento de efeitos colaterais colinolíticos.
Assim, a capacidade de bloquear receptores dopaminérgicos pós-sinápticos com um aumento compensatório na síntese e no metabolismo da dopamina é a única propriedade bioquímica comum para todos os neurolépticos considerados nesses grupos.
O sexto grupo inclui o único antipsicótico atípico, o aripiprazol, que surgiu no mercado psicofarmacológico nacional há relativamente pouco tempo. Este fármaco é um agonista parcial dos receptores D2-dopaminérgicos e atua como antagonista funcional em estados hiperdopaminérgicos e como agonista funcional em perfis hipodopaminérgicos. Este perfil de receptores único do aripiprazol permite reduzir o risco de distúrbios extrapiramidais e hiperprolactinemia durante o seu uso. Além disso, o aripiprazol atua como agonista parcial dos receptores 5-HT1a e, ao mesmo tempo, é um antagonista dos receptores 5-HT2a. Supõe-se que tal interação com os receptores leve a um funcionamento geralmente equilibrado dos sistemas serotoninérgico e dopaminérgico, de modo que o mecanismo de ação do aripiprazol pode ser designado como estabilizador do sistema dopamina-serotonina.
Assim, o nível atual de conhecimento sobre os mecanismos neuroquímicos de ação dos neurolépticos permite-nos propor uma nova classificação farmacodinâmica, patogeneticamente mais fundamentada, para este grupo de psicofármacos. A utilização desta classificação permite prever, em larga medida, o espectro de atividade psicotrópica, a tolerância e as prováveis interações medicamentosas de um determinado fármaco. Por outras palavras, as características da atividade neuroquímica de um fármaco determinam, em grande parte, as características da sua atividade clínica, que devem ser consideradas na escolha de um antipsicótico específico para um determinado doente.
A eficácia do efeito antipsicótico global de qualquer neuroléptico é estimada usando o chamado equivalente de clorpromazina, que é considerado igual a 1. Por exemplo, o equivalente de clorpromazina do haloperidol = 50. Isso significa que a eficácia antipsicótica de 1 mg de haloperidol é comparável a 50 mg de clorpromazina. Com base nesse indicador, foi desenvolvida uma classificação que prevê a alocação de neurolépticos com alta (equivalente de clorpromazina > 10,0), média (equivalente de clorpromazina = 1,0-10,0) e baixa (equivalente de clorpromazina = 1,0) atividade antipsicótica, chamada de patente. Neurolépticos típicos (antipsicóticos de primeira geração) têm sido amplamente utilizados na psicofarmacoterapia clínica por quase meio século. O espectro de sua atividade terapêutica inclui:
- ação antipsicótica global na forma da capacidade de reduzir de maneira uniforme e diferenciada várias manifestações de psicose:
- efeito sedativo primário (inibitório) - capacidade dos medicamentos de aliviar rapidamente a agitação psicomotora;
- ação antipsicótica seletiva e seletiva, manifestada na capacidade de influenciar sintomas individuais: delírio, alucinações, desinibição de impulsos, etc.;
- ação neurotrópica ativadora (desinibitória, desinibitória, antiautista), manifestada pelo desenvolvimento de sintomas extrapiramidais;
- ação somatotrópica na forma de desenvolvimento de efeitos colaterais neuroendócrinos e vegetativos;
- efeito depressivo, expresso na capacidade de alguns antipsicóticos de causar sintomas depressivos.
A eficácia dos antipsicóticos de primeira geração no tratamento não apenas de transtornos psicóticos, mas também de transtornos da psiquiatria borderline, foi comprovada inúmeras vezes e é indiscutível. Portanto, apesar da alta frequência de efeitos colaterais da terapia quando prescritos, eles continuam sendo utilizados na prática médica.
Antipsicóticos atípicos
Diretrizes modernas contêm dados sobre as vantagens do uso de antipsicóticos de segunda geração na farmacoterapia. O termo "atípico" (sinônimo - antipsicóticos de segunda geração) é condicional e é usado principalmente para a conveniência de designar a nova geração. Comparados aos neurolépticos tradicionais, os medicamentos desse grupo são mais eficazes na correção de transtornos negativos, afetivos e cognitivos, o que se combina com melhor tolerabilidade e menor risco de sintomas extrapiramidais. As diferenças na natureza do efeito terapêutico de um ou outro medicamento em uma série de antipsicóticos atípicos são explicadas, como no grupo dos neurolépticos típicos, por seu perfil individual de ação farmacológica.
Para esclarecer as possibilidades da psicofarmacoterapia com antipsicóticos atípicos, é aconselhável focar nos medicamentos desse grupo registrados na Rússia.
 [ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
[ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
Clozapina (dibenzodiazepina)
Fundador do grupo dos antipsicóticos atípicos. O mecanismo de ação da clozapina é caracterizado por um leve bloqueio dos receptores D2 com alto antagonismo simultâneo aos receptores 5-HT2a, α1, α2-adrenérgicos e H1-histamínicos. Demonstrou ser um antipsicótico eficaz em casos de resistência a outros antipsicóticos (um fármaco do grupo de reserva) e também é indicado para o tratamento de mania crônica, agitação psicótica e agressividade. Na prática clínica, a clozapina é frequentemente prescrita para sedação e como hipnótico em pacientes psicóticos. Deve-se reconhecer que tal uso da clozapina não corresponde ao seu principal perfil de indicações terapêuticas. Provavelmente, a atitude em relação a esse antipsicótico como um fármaco de importância secundária deva ser revista, visto que hoje é o único fármaco com eficácia comprovada em pacientes resistentes.
A clozapina, ao contrário dos neurolépticos típicos, não causa distúrbios extrapiramidais graves devido à baixa afinidade pelos receptores de O2 já mencionada. Também foi demonstrado que pode ser usada para tratar distonia tardia e acatisia grave. Devido ao baixo risco de desenvolver SNM, a clozapina pode ser considerada um medicamento de escolha em pacientes que já sofreram dessa complicação.
No entanto, vários efeitos colaterais graves podem se desenvolver durante o tratamento com clozapina. O mais perigoso deles (mesmo quando pequenas doses são prescritas) é a agranulocitose, que ocorre em 0,5% a 1% dos pacientes. Outros efeitos colaterais importantes que podem ocorrer com o uso do medicamento incluem sonolência, hipersalivação e ganho de peso, que frequentemente já está elevado quando a clozapina é prescrita sob a influência de terapia antipsicótica anterior. Também deve-se atentar para a possibilidade de desenvolver taquicardia, hipotensão arterial e convulsões epilépticas ao tomá-la. A probabilidade de convulsões depende da dose. O risco aumenta significativamente se a dose de clozapina exceder 600 mg/dia. O desenvolvimento de convulsões não é uma contraindicação para o uso posterior do medicamento, mas requer a redução da dose pela metade e a prescrição de anticonvulsivantes, como o ácido valpróico. A prevenção dos efeitos colaterais do tratamento com clozapina inclui o monitoramento cuidadoso da contagem de leucócitos, bem como do ECG e dos parâmetros endócrinos.
A overdose de clozapina pode causar depressão da consciência até o desenvolvimento de coma, bem como sintomas associados ao efeito colinolítico (taquicardia, delírio), convulsões epilépticas, depressão respiratória e síndromes extrapiramidais. Pode ocorrer morte ao tomar uma dose superior a 2500 mg do medicamento.
 [ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ], [ 41 ]
[ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ], [ 41 ]
Risperidona
Derivado do benzisoxazol com alta afinidade pelos receptores Dj de serotonina e dopamina, com efeito predominante no sistema serotoninérgico. O medicamento possui uma ampla gama de indicações, incluindo alívio de exacerbações, tratamento antirrecaída, terapia para o primeiro episódio psicótico e correção dos sintomas negativos da esquizofrenia. Demonstrou-se que o medicamento melhora o funcionamento cognitivo em pacientes com esquizofrenia. Dados preliminares indicam que a risperidona também reduz os sintomas afetivos comórbidos em pacientes com esquizofrenia e pode ser um medicamento de escolha no tratamento de transtornos afetivos bipolares.
Os efeitos colaterais da terapia com risperidona, especialmente distúrbios extrapiramidais, são dose-dependentes e ocorrem com mais frequência em doses superiores a 6 mg/dia. Outros efeitos colaterais incluem náuseas, vômitos, ansiedade, sonolência e aumento dos níveis séricos de prolactina. O uso prolongado de risperidona pode levar ao ganho de peso e ao desenvolvimento de diabetes mellitus tipo 2, mas com menor probabilidade em comparação com clozapina e olanzapina.
A superdosagem pode causar sonolência, crises epilépticas, prolongamento do intervalo QT e alargamento do complexo QRS, além de hipotensão arterial. Foram descritos casos fatais devido à superdosagem de risperidona.
A vantagem indiscutível do medicamento é a disponibilidade de formas líquidas e de rápida dissolução (sublinguais), cujo uso acelera a entrada do medicamento no organismo do paciente e facilita o controle da sua ingestão. Existe também uma forma prolongada do medicamento - pó para a preparação de uma suspensão para administração intramuscular (consta-risperidona em microesferas). É recomendado para o tratamento de manutenção de pacientes com esquizofrenia, especialmente para pacientes com baixa adesão ao tratamento. É necessário levar em consideração o fato de que o medicamento precisa de cerca de três semanas para entrar na corrente sanguínea; portanto, ao iniciar o tratamento com consta-risperidona, o paciente deve tomar adicionalmente a forma oral de risperidona por pelo menos 3 semanas após a primeira injeção.
Olanzapina
Em termos de ação farmacológica, aproxima-se da clozapina, pois apresenta um perfil de receptores pleiomórficos com afinidade significativa pelos receptores serotoninérgicos, muscarínicos, α1-adrenérgicos e histamínicos. A atividade terapêutica da olanzapina apresenta características semelhantes à eficácia da clozapina e da risperidona em termos de impacto nos sintomas positivos, negativos e depressivos da esquizofrenia. Ao mesmo tempo, foram obtidos dados sobre a maior eficácia da olanzapina em comparação com outros antipsicóticos atípicos em pacientes com o primeiro episódio psicótico e na correção de indicadores de funcionamento cognitivo. Deve-se levar em consideração que, no início da terapia com a forma de comprimido do medicamento, pode ocorrer um rápido efeito desinibitório com aumento da agitação psicomotora e da ansiedade. Portanto, no tratamento de crises acompanhadas de agitação psicomotora grave, o uso da forma injetável do medicamento é indicado.
A olanzapina raramente causa distúrbios extrapiramidais ou discinesia tardia, e os efeitos colaterais mais comuns com seu uso são distúrbios metabólicos e ganho de peso. Foi estabelecido que pacientes que recebem olanzapina frequentemente apresentam níveis elevados de colesterol, lipídios plasmáticos e predisposição ao diabetes mellitus tipo 2, mas tais efeitos foram igualmente comuns em pacientes que recebem olanzapina e clozapina. Ao mesmo tempo, foram obtidos dados mostrando que o ganho de peso se correlaciona com uma resposta positiva à olanzapina (ou seja, serve como um importante indicador prognóstico da terapia) e evolui para obesidade em apenas 20-30% dos pacientes que ganharam excesso de peso durante o tratamento.
A superdosagem pode causar sedação, efeitos anticolinérgicos tóxicos, convulsões epilépticas e hipotensão arterial. Atualmente, não há dados convincentes para avaliar o risco de morte por superdosagem.
Quetiapina
É classificado como um composto dibenzotiazepínico. Seu perfil de receptores é bastante semelhante ao da clozapina. O nível de ligação da quetiapina aos receptores D2 é baixo (menos de 50%) e de curta duração, mesmo quando utilizadas doses elevadas. O fármaco é eficaz no tratamento dos sintomas positivos, negativos e gerais da esquizofrenia. Há evidências de seu uso bem-sucedido tanto em casos de alta resistência à terapia quanto na melhora do funcionamento cognitivo dos pacientes, o que o autoriza a recomendá-lo como antipsicótico de primeira linha para a terapia de manutenção da esquizofrenia. Por fim, a quetiapina possui um efeito antidepressivo moderado e ativador. Portanto, é indicada no tratamento de crises depressivo-delirantes e transtornos do ciclo senesto-hipocondríaco.
A elevada atividade timotrópica comprovada da quetiapina explica o fato de ser registrada como um meio para o alívio e a prevenção secundária de transtornos depressivos. Para o tratamento de episódios maníacos em transtornos bipolares tipo I e II, a quetiapina é usada como um meio adicional. A ausência de formas injetáveis limita um pouco seu uso em pacientes com agitação e comportamento agressivo.
A quetiapina é bem tolerada e praticamente não causa síndromes extrapiramidais, exceto em casos de doses máximas. A quetiapina não causa hiperprolactinemia, sendo menos comum que a olanzapina e a clozapina, mas leva ao ganho de peso e à diminuição da tolerância à glicose.
Ziprasidona
Possui um perfil único de atividade receptora. Sendo um potente antagonista dos receptores 5HT2a e D2, também é um inibidor ativo da recaptação de serotonina e norepinefrina. Estudos clínicos demonstraram superioridade significativa da ziprasidona em seu efeito sobre sintomas psicóticos e manifestações de agressividade em comparação ao haloperidol. Há também dados sobre o efeito positivo da ziprasidona nas funções cognitivas de pacientes com esquizofrenia, bem como em sintomas afetivos comórbidos, indicadores de funcionamento social. A ziprasidona é geralmente bem tolerada e muito raramente causa síndromes extrapiramidais, ganho de peso e distúrbios metabólicos. Mais frequentemente, há uma extensão do intervalo QT acima de 460 ms; portanto, é aconselhável que os pacientes que recebem este medicamento sejam submetidos a um exame de ECG antes da prescrição do medicamento e ao monitoramento de controle durante o tratamento. Deve-se prestar atenção especial à terapia concomitante (uso de medicamentos antiarrítmicos), que pode agravar o prolongamento do intervalo QT e levar ao desenvolvimento de arritmia cardíaca e fibrilação ventricular.
Sertindol
Pertence aos derivados do fenilindol. Apresenta alto antagonismo funcional em relação aos receptores D2, serotoninérgicos (especialmente 5-HT2a) e a1-adrenérgicos. De acordo com estudos eletroneuroquímicos, o sertindol inibe seletivamente os receptores de dopamina na região segmentar ventral. Essa seletividade, com toda a probabilidade, garante um baixo risco de síndromes extrapiramidais e hiperprolactinemia ao usar o medicamento. Os resultados de estudos comparativos mostraram que o sertindol é comparável ao haloperidol em termos de atividade antipsicótica. O medicamento tem um efeito desinibitório pronunciado em pacientes com sintomas negativos e depressivos, que é superior a um efeito semelhante do rispolept. Há também evidências que confirmam a eficácia do sertindol para a correção do comprometimento cognitivo em pacientes com esquizofrenia. O sertindol é geralmente bem tolerado pelos pacientes, raramente causa sedação e, portanto, é recomendado como medicamento de substituição quando ocorrem efeitos colaterais durante a terapia com outros antipsicóticos modernos.
Efeitos colaterais graves incluem a capacidade do medicamento de prolongar o intervalo QT, o que pode levar a arritmias cardíacas. Ao analisar estudos pós-comercialização, ficou claro que o perfil cardíaco do sertindol não difere do de outros antipsicóticos de nova geração.
Aripiprazol
Possui atividade antipsicótica comparável a outros agentes atípicos, mas tem um efeito maior nos parâmetros do funcionamento cognitivo de pacientes com esquizofrenia. A ação farmacológica única do medicamento – um agonista parcial dos receptores D2 – permite reduzir o risco de síndromes extrapiramidais e hiperprolactinemia quando utilizado.
 [ 42 ], [ 43 ], [ 44 ], [ 45 ], [ 46 ], [ 47 ]
[ 42 ], [ 43 ], [ 44 ], [ 45 ], [ 46 ], [ 47 ]
Amisulprida
Pertence à classe das benzamidas substituídas. O fármaco liga-se seletivamente aos subtipos de receptores dopaminérgicos D2 e D3, não possuindo afinidade pelos subtipos D1, D4 e D5, bem como pelos receptores serotoninérgicos, histamínicos H1, adrenérgicos alfa1 e colinérgicos. Quando utilizado em doses elevadas, bloqueia os receptores D2 pós-sinápticos. Em doses baixas, o seu efeito desinibitório manifesta-se devido ao bloqueio dos receptores D2 e D3 pré-sinápticos, pelo que a sua utilização também é eficaz no tratamento de sintomas negativos, embora não seja um antagonista combinado dos receptores D2 e serotoninérgicos. Os resultados de vários estudos indicam uma atividade antipsicótica pronunciada do fármaco quando utilizado em doses elevadas, superior à dos fármacos tradicionais.
 [ 48 ], [ 49 ], [ 50 ], [ 51 ], [ 52 ], [ 53 ], [ 54 ], [ 55 ]
[ 48 ], [ 49 ], [ 50 ], [ 51 ], [ 52 ], [ 53 ], [ 54 ], [ 55 ]
Efeitos colaterais da terapia antipsicótica
A tabela lista os principais efeitos colaterais da terapia antipsicótica atípica.
Preparação |
|
Perturbação de condução no ECG |
Distúrbios metabólicos (ganho de peso, aumento dos níveis de glicose, colesterol, triglicerídeos no sangue) |
||
Clozapina |
. |
++ |
++ |
++- |
|
Risperidona |
++ |
+/- |
++ |
+/- |
|
Olanzapina |
+ |
+/- |
+++ |
++ |
+++ |
Quetiapina |
+/- |
+ |
+/- |
--- |
|
Ziprasidona |
+ |
++ |
+/- |
+/- |
+/- |
Sertindol |
++ |
-- |
+/- |
-- |
|
Ariliprazol |
-- |
--- |
+/- |
-- |
-- |
Amisulprida |
++ |
+/- |
|||
Nota. Gravidade dos efeitos colaterais: "+++" - alta; "++" - média; "+" - baixa; "+/-" - questionável; "-" - ausente.
Síndromes extrapiramidais
Uma das principais características dos antipsicóticos atípicos, em contraste com os tradicionais, é sua baixa capacidade de causar síndromes extrapiramidais, o que representou um avanço na farmacoterapia de manutenção da esquizofrenia. No entanto, como se depreende dos dados da tabela, ao utilizar medicamentos individuais desta série (risperidona, amissulprida), tais sintomas podem ocorrer, o que requer atenção especial na sua prescrição.
 [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
[ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
Anormalidades no ECG
A possibilidade de desenvolver efeitos colaterais cardíacos é um problema sério ao usar alguns antipsicóticos modernos na terapia. Nesses casos, estamos falando de prolongamento do intervalo QT, que pode levar ao desenvolvimento de arritmia. Distúrbios de condução, principalmente prolongamento do intervalo QT, são mais frequentemente observados durante o tratamento com clozapina, sertindol e ziprasidona. Patologias concomitantes na forma de bradicardia, bloqueio atrioventricular e hipotireoidismo podem contribuir para a ocorrência dessa complicação durante o tratamento com os medicamentos mencionados. Atualmente, o monitoramento por ECG é recomendado aproximadamente uma vez a cada 3 meses em pacientes em terapia de manutenção com antipsicóticos atípicos.
 [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ]
[ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ]
Distúrbios endócrinos
Atualmente, a maior preocupação é causada pela capacidade dos medicamentos antipsicóticos atípicos de causar ganho de peso. O aumento do peso corporal, dos níveis de glicose e triglicerídeos no sangue pode levar a distúrbios metabólicos e ao desenvolvimento de diabetes tipo 2. Cuidado especial e monitoramento semanal dos parâmetros bioquímicos são necessários durante a terapia com clozapina e olanzapina. De acordo com J. Geddes et al. (2000), PB Jones, PF Buckley (2006), deve-se reconhecer como apropriado conduzir um exame completo dos pacientes antes de prescrever-lhes um antipsicótico específico da geração moderna, uma vez que se sabe que os distúrbios metabólicos ocorrem com mais frequência em pacientes que tinham predisposição hereditária, excesso de peso corporal, distúrbios do espectro lipídico e hiperglicemia antes do início do tratamento. O algoritmo de monitoramento proposto por PB Jones, PF Buckley (2006) inclui vários pontos.
- Coleta de histórico médico e fatores familiares relacionados ao risco de distúrbios metabólicos.
- Registro do índice de massa corporal, ECG, pressão arterial e pulso antes do início do tratamento.
- Coleta de dados laboratoriais (glicemia, perfil lipídico, colesterol) antes de iniciar a terapia.
- Monitoramento regular do índice de massa corporal e sinais vitais durante o tratamento.
- Monitoramento de dados laboratoriais durante o tratamento.
A ocorrência de hiperprolactinemia durante o tratamento com antipsicóticos se deve ao bloqueio central dos receptores de dopamina no hipotálamo, o que leva à liberação de prolactina pela hipófise anterior. A hiperprolactinemia ocorre mais frequentemente com o tratamento com olanzapina, risperidona e amissulprida.
 [ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ]
[ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ]
Agranulocitose
Outra complicação grave da terapia antipsicótica. Pode ser observada durante o tratamento com clozapina e olanzapina. De acordo com J. Geddes et al. (2000), foi diagnosticada durante os primeiros 3 meses em 1-2% dos pacientes que tomam esses medicamentos. Nesse sentido, recomenda-se exames de sangue semanais para pacientes que tomam esses medicamentos durante as primeiras 18 semanas de terapia e monitoramento mensal a partir de então. Foi demonstrado que, quando a dose dos neurolépticos mencionados acima é reduzida, o exame de sangue clínico retorna ao normal. Ao mesmo tempo, deve-se reconhecer que, até o momento, não há uma estratégia clara para pacientes que apresentam os efeitos colaterais acima mencionados associados a distúrbios metabólicos. Na maioria das vezes, um antipsicótico atípico é substituído por outro. Outra direção promissora é a indicação de terapia corretiva especial, em particular o uso de bromocriptina para corrigir a hiperprolactinemia. A situação ideal é aquela em que o cuidado de um paciente com tais distúrbios seja realizado com o envolvimento periódico de médicos internistas, em especial endocrinologistas, cardiologistas e outros especialistas.
Concluindo, deve-se observar que, se os algoritmos fornecidos para prescrição e monitoramento não apenas do estado mental, mas também físico dos pacientes forem seguidos, o uso de medicamentos de segunda geração é mais seguro do que os neurolépticos típicos.
Vários outros antipsicóticos estão atualmente em fase de desenvolvimento. Medicamentos de próxima geração provavelmente terão um mecanismo de ação diferente (por exemplo, um perfil GABAérgico) e serão capazes de influenciar diversas manifestações da esquizofrenia, incluindo transtornos de déficit de atenção propriamente ditos.
Atenção!
Para simplificar a percepção da informação, esta instrução do uso da droga "Neurolépticos ou antipsicóticos " traduziu e apresentou em uma forma especial com base nas instruções oficiais do uso médico da droga. Antes de usar, leia a anotação que veio diretamente para a medicação.
Descrição fornecida para fins informativos e não é um guia para a autocura. A necessidade desta droga, a finalidade do regime de tratamento, métodos e dose da droga é determinada exclusivamente pelo médico assistente. A automedicação é perigosa para a sua saúde.

