Médico especialista do artigo
Novas publicações
Medicamentos
Medicamentos que previnem a trombose e melhoram a reologia do sangue
Última revisão: 07.07.2025

Todo o conteúdo do iLive é medicamente revisado ou verificado pelos fatos para garantir o máximo de precisão factual possível.
Temos diretrizes rigorosas de fornecimento e vinculamos apenas sites de mídia respeitáveis, instituições de pesquisa acadêmica e, sempre que possível, estudos médicos revisados por pares. Observe que os números entre parênteses ([1], [2], etc.) são links clicáveis para esses estudos.
Se você achar que algum dos nossos conteúdos é impreciso, desatualizado ou questionável, selecione-o e pressione Ctrl + Enter.
Na prevenção da formação de múltiplos microtrombos durante o choque e sua destruição, podem ser utilizadas diversas abordagens farmacológicas que utilizam fármacos que previnem a formação de trombos e melhoram a reologia sanguínea:
- eliminação de distúrbios hemodinâmicos sistêmicos e da microcirculação com o uso de agentes vasoativos e inotrópicos;
- medidas para melhorar a reologia sanguínea usando terapia de infusão racional e medicamentos que restauram a elasticidade das membranas dos eritrócitos (trental ou pentoxifilina);
- prevenção da agregação plaquetária e da formação de trombos “brancos” iniciais em pequenos vasos arteriais com subsequente início da cascata de coagulação;
- inibição da formação de trombos após ativação da cascata de coagulação sistêmica;
- ativação da fibrinólise com o objetivo de dissolver coágulos sanguíneos recém-formados (fibrinolisina, estreptoquinase, estreptodecase, uroquinase, etc.) ou, ao contrário, inibição da fibrinólise quando generalizada em alguns pacientes com choque traumático e sepse (ácido aminocapróico, amben, contrical, etc.).
A maioria das abordagens listadas são tradicionais, bem desenvolvidas na prática do tratamento do choque, têm suas próprias indicações hemorreológicas e são especificadas nos capítulos relevantes. Portanto, nesta seção, é aconselhável abordar a abordagem geral para a prevenção da formação de trombos no choque, utilizando agentes farmacológicos que afetam a prófase da coagulação sanguínea. É esse nível de prevenção de complicações da coagulação – a ocorrência, a formação e o crescimento de "trombos arteriais brancos" – que atrai a maior atenção dos pesquisadores.
Distúrbios variados e frequentemente multidirecionais da coagulação sanguínea, com deterioração de sua reologia, são característicos de diferentes tipos de choque. O mais característico dos tipos séptico, endotóxico, por queimadura, traumático e hemorrágico é a formação de múltiplos microtrombos nos vasos menores, causados por distúrbios da hemodinâmica sistêmica, vasoespasmo e distúrbios da microcirculação, espessamento sanguíneo, lodo, diminuição da elasticidade das membranas eritrocitárias, bem como numerosos fatores gerais e locais (autocoides) que desencadeiam alterações locais na hemostasia da coagulação e a inclusão da prófase da coagulação sanguínea.
De forma esquemática (abreviada), o estágio inicial da hemocoagulação e o mecanismo de homeostase local da hemocoagulação são apresentados a seguir.
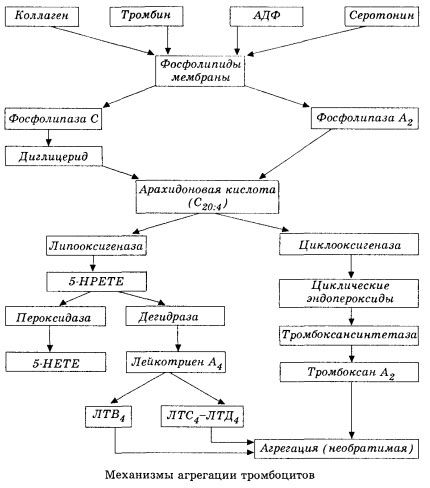
Começa com a ativação da fosfolipase A2 da membrana, como resultado do impacto de uma combinação de fatores danosos (dano direto à membrana, hipóxia, peroxidação lipídica, impacto de fatores químicos endógenos, etc.). Como resultado da quebra dos fosfolipídios da membrana, são liberados ácidos graxos de cadeia longa não esterificados, dos quais o ácido araquidônico é o mais importante como substrato inicial. Sua transformação (cascata do ácido araquidônico) ocorre pelas vias da lipoxigenase (síntese de leucotrienos) e da ciclooxigenase (síntese de prostaglandinas, tromboxanos, prostaciclinas).
Os leucotrienos resultantes (B4, C4, E4, D4, etc.) – substâncias com atividade biológica extremamente alta, incluindo a substância de reação lenta da anafilaxia – são de grande importância no início de reações vasculares, inflamatórias e imunológicas locais, incluindo processos autoimunes. Os leucotrienos causam distúrbios da microcirculação, aumento da coagulação sanguínea, liberação de enzimas lisossômicas autolíticas e liberação no sangue de um fator que inibe a contratilidade miocárdica e o espasmo brônquico.
Devido à sua capacidade de causar contração do músculo liso, os leucotrienos afetam significativamente a hemodinâmica sistêmica, os vasos coronários e o miocárdio, exercendo um poderoso efeito constritor coronário e inotrópico negativo, que é acompanhado por uma diminuição do débito cardíaco e desempenha um papel importante no desenvolvimento de hipotensão.
A redução do débito cardíaco e a resposta hipotensiva aos leucotrienos estão associadas ao enfraquecimento do músculo cardíaco e à limitação do retorno venoso ao coração. De grande importância na limitação do retorno venoso é a capacidade dos leucotrienos de aumentar a permeabilidade da parede vascular e causar extravasamento plasmático. Os leucotrienos são considerados importantes na patogênese do infarto do miocárdio.
No choque anafilático e séptico (endotoxina), seu papel aparentemente aumenta ainda mais, como evidenciado pela capacidade dos leucotrienos de se acumularem em quantidades significativas no plasma durante reações alérgicas e de causar alterações no fluxo sanguíneo sistêmico características do choque anafilático, bem como pelos efeitos protetores dos bloqueadores dos receptores de leucotrienos e inibidores da lipoxigenase. O desenvolvimento de bloqueadores seletivos dos receptores de leucotrienos está sendo realizado de forma bastante intensiva e representa uma direção promissora da ciência. Nessa área, já houve algum sucesso e a eficácia desses bloqueadores na isquemia miocárdica, endotoxina e choque hemorrágico foi confirmada experimentalmente. No entanto, provavelmente levará mais alguns anos até que essa direção seja implementada clinicamente.
Se nos vasos venosos os trombos são formados com igual participação de trombócitos e fatores de coagulação do plasma, nas artérias os trombócitos são os principais iniciadores do processo. Eles contêm ADP, Ca2+, serotonina, fosfolipídios, enzimas de síntese de prostaglandina e tromboxano, trombostenina (como a actomiosina muscular fornece a capacidade contrátil dessas células), fator de crescimento trombogênico do epitélio e células musculares da parede vascular e uma série de outras substâncias. A regulação humoral das funções dos trombócitos é realizada por meio de receptores especializados em suas membranas (receptores adrenérgicos alfa2 e beta2, receptores para histamina e serotonina, acetilcolina, tromboxano, adenosina e vários outros). Uma propriedade especial dos trombócitos é sua alta afinidade por colágeno e outros elementos subendoteliais da parede vascular, por superfícies não umectantes e carregadas negativamente. Essa propriedade confere aos trombócitos uma capacidade excepcional de aderir (grudar) a uma seção de um vaso com endotélio danificado, que tem ampla oportunidade de ser danificado durante o choque. Nesse caso, os trombócitos se espalham e liberam pseudópodes, que podem aderir uns aos outros e à parede do vaso. A permeabilidade da membrana aumenta, e ADP, serotonina, tromboxano e alguns fatores de coagulação adsorvidos na superfície do trombócitos são liberados dos trombócitos. Essas substâncias interagem com os receptores correspondentes na membrana e, com a participação de íons de cálcio, causam agregação (inicialmente reversível). O processo torna-se autossustentável, o que é facilitado por fatores reguladores humorais; outros fatores, ao contrário, podem interrompê-lo e até mesmo revertê-lo, causando desagregação.
Com a predominância de influências e condições formadoras de trombos, as fases de adesão e agregação reversível são substituídas pela terceira fase - agregação irreversível, que é realizada com a participação da trombostenina e leva à constrição do coágulo; a reação de fortalecimento do agregante e constrição também ocorre com a participação de Ca +, ATP e leva à formação de um trombo branco.
A via da ciclooxigenase na conversão do ácido araquidônico em plaquetas, células endoteliais vasculares e outros tecidos garante a homeostase local da coagulação (a meia-vida dos metabólitos é muito curta), visto que potentes substâncias pró e antiagregantes são formadas durante esse metabolismo. O principal fator que ativa a agregação plaquetária na cadeia de reações da ciclooxigenase é o tromboxano A2, e seu antagonista não menos potente é a prostaciclina, produzida pelas células endoteliais e, em menor grau, pelas prostaglandinas das séries E e G. Por fim, a agregação plaquetária é fortemente influenciada por fatores humorais locais e sistêmicos adicionais.
Ativadores e inibidores da agregação plaquetária
Iniciadores e ativadores da agregação plaquetária |
Inibidores da agregação plaquetária |
Colágeno |
- |
ADP |
Adenosina e seus estabilizadores |
Norepinefrina (via receptores alfa2) |
Agentes bloqueadores alfa-adrenérgicos |
Serotonina |
Agentes antiserotonina |
Histamina |
Anti-histamínicos |
Trombina |
Heparina |
Ca2+ |
Antagonistas de Ca2+ |
CGMP - seus indutores (acetilcolina?) e estabilizadores |
CAM - seus indutores (via receptores beta-adrenérgicos) e estabilizadores (inibidores da fosfodiesterase) |
Ácido araquidônico |
Dextranos, albumina |
Tromboxano A2 |
Prostaciclina I2 |
Intervenções farmacológicas na fase inicial de formação de trombos em choque e processos isquêmicos agudos no coração e no cérebro sugerem a seguinte possibilidade:
- inibição das reações iniciais (totais e parciais) da cascata do ácido araquidônico;
- inibição de uma reação específica da síntese de tromboxano;
- bloqueio de receptores para leucotrienos e tromboxanos em plaquetas, músculo liso e outras células;
- o uso de substâncias que modulam a agregação plaquetária, ou seja, enfraquecem de outras maneiras a reação desta última à influência de fatores iniciadores (colágeno, tromboxano A2, leucotrienos, etc.).
A implementação dos métodos listados para correção de distúrbios das propriedades reológicas do sangue permite a solução da principal tarefa tática: proteger os receptores de agregação e adesão plaquetária da ação de ativadores ou suprimir os mecanismos intracelulares de síntese desses receptores. A inibição das reações iniciais da cascata do ácido araquidônico pode ser alcançada pela proteção dos receptores plaquetários que reagem a ativadores poliméricos, utilizando dextranos de baixo peso molecular, cujas moléculas competem com fibrina, colágeno, imunoglobulina agregada (IgE) e componentes do sistema complemento.
Ao mascarar os receptores na membrana plaquetária e competir com proteínas de grande dispersão na superfície dos eritrócitos, os dextranos de baixo peso molecular os deslocam e destroem as pontes entre as células. Isso se deve ao fato de que os dextranos, ao envolverem o endotélio vascular e a superfície dos elementos celulares sanguíneos, aumentam sua carga negativa, potencializando assim as propriedades antiagregantes.
Dextranos
Dextranos de baixo peso molecular reduzem a agregação plaquetária induzida por colágeno e ADP, bem como o efeito ativador da trombina nas plaquetas, inibem o crescimento do trombo plaquetário branco inicial, melhoram o fluxo sanguíneo, reduzem o aumento pós-operatório no conteúdo de fibrinogênio plasmático e alteram a estrutura e a estabilidade da fibrina.
Infusões intravenosas de dextranos em traumas e choques não apenas reduzem a agregação e a adesão plaquetária, como também mobilizam a heparina endógena, promovendo assim a formação de um coágulo sanguíneo frouxo e pouco retrátil, que é facilmente lisado por fibrinolíticos. A atividade antitrombina dos dextranos de baixo peso molecular está associada ao seu efeito específico sobre a estrutura e a função do fator VIII da coagulação sanguínea. O fator VIII (globulina anti-hemofílica), uma molécula grande com estrutura e função complexas, está envolvido na agregação plaquetária e na estabilidade do coágulo resultante. Os dextranos interferem na ação do fator VIII, retardando a agregação plaquetária e reduzindo a estabilidade do coágulo.
Dextranos de baixo peso molecular não são anticoagulantes verdadeiros e seu efeito corretivo em distúrbios hemorreológicos está associado principalmente à hemodiluição, reposição do volume plasmático circulante e melhora do fluxo sanguíneo no sistema de microcirculação.
A capacidade dos dextranos de melhorar o fluxo sanguíneo em distúrbios hemodinâmicos (choque, perda sanguínea) deve-se a um complexo de fatores. A ocorrência de uma alta concentração transitória do polímero no sangue não só leva à "hemodiluição direta", como também cria condições para o fluxo de fluido do espaço intersticial para a corrente sanguínea e o subsequente equilíbrio do efeito osmótico do dextrano. Como consequência da hemodiluição, a viscosidade sanguínea diminui, o fluxo venoso para o coração aumenta e o débito cardíaco aumenta. Juntamente com esses efeitos, os dextranos formam complexos com o fibrinogênio e têm um efeito antilipêmico.
Assim, a ação antiagregante e os efeitos hemodinâmicos dos dextranos de baixo peso molecular ajudam a reduzir a viscosidade sanguínea, o que é especialmente importante em baixas taxas de cisalhamento. A desagregação das células sanguíneas melhora o fluxo sanguíneo sistêmico e a microcirculação, especialmente em sua parte venosa, onde os gradientes de velocidade são os mais baixos. O uso de soluções de dextrano de baixo peso molecular em vários tipos de choque, durante o tratamento cirúrgico de lesões e suas consequências, e posteriormente no período pós-operatório, ajuda a prevenir a hipercoagulação e reduzir a probabilidade de processos trombóticos e embolia.
No entanto, deve-se observar que, em alguns casos, as infusões de soluções de dextrana são acompanhadas de reações anafiláticas e alérgicas (perigosas na presença de sensibilização e choque anafilático). Isso se deve ao fato de que as dextranas, que possuem alto peso molecular e muitas cadeias laterais, podem atuar como antígenos. Portanto, para estabelecer a sensibilidade individual, recomenda-se a pré-administração intravenosa de até 20 ml de uma solução de dextrana de baixo peso molecular como hapteno (solução a 15%, peso molecular 1000) e a realização de infusões de um substituto plasmático antes da introdução da anestesia.
 [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ]
[ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ]
Inibidores da trombina
A proteção farmacológica dos receptores plaquetários que interagem com os ativadores plaquetários também pode ser alcançada por meio de agentes que competem com os ativadores plaquetários não poliméricos ou os inibem. Esses agentes incluem inibidores da trombina (heparina e hirudina, diversos inibidores sintéticos, antagonistas da adrenalina), bloqueadores dos receptores alfa (fentolamina, di-hidroergotamina), antagonistas do ADP (dipiridamol, adenosina e seus análogos estruturais, fosfocreatina) e antagonistas da serotonina (metisergida). Apenas alguns dos agentes listados são efetivamente utilizados na prevenção e no tratamento do choque de diversas origens.
A proteção dos mecanismos intracelulares de síntese de receptores de proteínas que reagem com ativadores de agregação e adesão plaquetária e a inibição dos processos de síntese de tromboxano são possíveis com medicamentos de vários grupos:
- indutores e estabilizadores de cATP, prostaciclina e prostaglandina PgE2;
- inibidores de fosfolipase e fosfodiesterase.
O desenvolvimento intensivo de agentes antiplaquetários especiais começou há relativamente pouco tempo e ainda não produziu resultados confiáveis. Atualmente, na prática clínica, além das soluções de dextrana, agentes antiplaquetários como ácido acetilsalicílico, indometacina, dipiradamol, sulfinpirazona (persantina), prostaciclina (eicoprostenona) e heparina são amplamente utilizados para prevenir a formação de trombos plaquetários brancos.
Medicamentos anti-inflamatórios não esteroidais
Foi estabelecido que os efeitos farmacológicos dos anti-inflamatórios não esteroidais – ácido acetilsalicílico e indometacina – se devem ao seu efeito no metabolismo de eicosanoides (tromboxanos e prostaglandinas). Quase todos os medicamentos deste grupo inibem o complexo enzimático conhecido como prostaglandina sintetase, exercendo assim seus efeitos específicos e antiagregantes.
O ácido acetilsalicílico é absorvido muito rapidamente após administração oral. O produto de sua hidrólise, o ácido salicílico, causa inibição da ciclooxigenase plaquetária, o que interrompe a conversão do ácido araquidônico em prostaglandina O2 e, por fim, em tromboxano A2. O ácido acetilsalicílico inibe a agregação induzida por colágeno, ADP, adrenalina e serotonina. Embora seu tempo de ação seja de 15 minutos, o efeito antiagregante dura vários dias, o que é aparentemente explicado pela inibição irreversível das reações de síntese de prostaglandinas e pela supressão da função de agregação plaquetária ao longo de toda a sua vida (6 a 10 dias). Juntamente com a inibição da ciclooxigenase plaquetária, o ácido acetilsalicílico em altas doses inibe a ciclooxigenase da parede vascular e, simultaneamente à supressão da síntese de tromboxano A2, inibe a síntese de prostaciclina nas células endoteliais. Portanto, o ácido acetilsalicílico deve ser prescrito como antiagregante plaquetário em pequenas doses (3000-5000 mg/dia), que inibem predominantemente a agregação plaquetária.
Considerando que o ácido acetilsalicílico bloqueia a ciclooxigenase plaquetária por vários dias e a ciclooxigenase endotelial por não mais que um dia, é racional prescrever o medicamento não diariamente, mas a cada 3-4 dias. A seleção da dose ideal de ácido acetilsalicílico para cada paciente deve ser realizada individualmente, visto que cada paciente apresenta sensibilidade diferente ao efeito antiplaquetário do medicamento. Em pacientes reativos, o ácido acetilsalicílico na dose de 0,5 g inibe a agregação plaquetária em 40-50%, em pacientes hiperreativos - completamente ou em 80-90%, e em pacientes reativos, a ausência de efeito antiplaquetário é característica ao tomar a mesma dose do medicamento.
Os inibidores seletivos da tromboxano sintetase são o imidazol e seus análogos, que não bloqueiam a ciclooxigenase. O dipiridamol, utilizado na prática clínica no tratamento da cardiopatia isquêmica crônica como dilatador coronário, assim como o imidazol, inibe seletivamente a tromboxano sintetase, impedindo a síntese de tromboxano A2. Acredita-se que o fármaco e seus análogos também inibam a fosfodiesterase plaquetária, aumentando assim a concentração de AMPc nas plaquetas. Além disso, o dipiridamol inibe a atividade da adenosina desaminase e a captação de adenosina pelas plaquetas, bloqueia a absorção de serotonina pelas plaquetas e sua agregação induzida por adrenalina e colágeno. Há relatos de fraca atividade antiplaquetária do fármaco e sua capacidade, em pequenas doses, de aumentar a agregação plaquetária. O efeito antiplaquetário mais confiável pode ser alcançado com uma combinação de dipiridamol e ácido acetilsalicílico.
Heparina
Entre os agentes antitrombóticos, um dos reguladores mais eficazes do estado agregado do sangue é a heparina, especialmente quando usada precocemente. A heparina possui alta carga negativa e é capaz de interagir com íons e moléculas grandes e pequenas (enzimas, hormônios, aminas biogênicas, proteínas plasmáticas, etc.), portanto, seu espectro de ação biológica é bastante amplo. O fármaco possui efeitos antitrombínicos, antitromboplastínicos e antiprotrombínicos, previne a conversão de fibrinogênio em fibrina, suprime a retração do coágulo e aumenta a fibrinólise.
O mecanismo da ação anticoagulante da heparina é bastante complexo. Foi estabelecido atualmente que os efeitos anticoagulantes da heparina estão associados à potencialização da ação da antitrombina III e ao aumento da capacidade do complexo heparina-antitrombina III de inativar rapidamente a maioria das serinoproteases do sistema de coagulação sanguínea. No efeito antitrombótico da heparina, sua capacidade de aumentar e manter um alto potencial eletronegativo da íntima vascular, prevenindo a adesão plaquetária e a formação de microtrombos plaquetários, é de grande importância. A heparina suprime ativamente a formação de trombos nas veias, prevenindo tanto a formação local de trombos quanto a coagulação intravascular disseminada.
Prostaciclina e seus análogos estáveis
Entre os agentes antiplaquetários, os inibidores de agregação mais potentes são a prostaciclina e seus análogos estáveis. O efeito antiplaquetário da prostaciclina se deve à estimulação da adenilato ciclase e, consequentemente, ao aumento da concentração de AMPc nas plaquetas, à diminuição do conteúdo de tromboxano, à diminuição do conteúdo de tromboxano A2 e ao bloqueio de seus receptores. A prostaciclina é instável e se hidrolisa rapidamente em produtos inativos, por isso é administrada por via intravenosa, por gotejamento, a uma taxa de 2 a 20 ng/kg por minuto, durante 30 a 60 minutos, até 6 vezes ao dia.
A prostaciclina, além de um forte efeito antiagregante, possui um potente efeito vasodilatador e broncodilatador. O medicamento dilata os vasos do cérebro, coração, rins, músculos esqueléticos e vasos mesentéricos. Sob a influência da prostaciclina, o fluxo sanguíneo coronário aumenta, o suprimento de energia do miocárdio aumenta e sua necessidade de oxigênio diminui. Apesar de sua instabilidade no organismo, os efeitos clinicamente favoráveis podem durar várias semanas e até meses. O mecanismo dessa ação prolongada ainda não está claro.
A prostaciclina é um medicamento pouco tóxico, mas seu uso pode causar efeitos colaterais: rubor facial, dores de cabeça, diminuição da pressão arterial, dor abdominal e anorexia. Juntamente com a prostaciclina, seus análogos sintéticos estáveis (iloprosta, etc.) são inibidores promissores da agregação plaquetária.
Medicamentos que melhoram a viscosidade do sangue
Distúrbios nas propriedades reológicas do sangue durante traumas e choques são causados não apenas por alterações na atividade funcional das plaquetas, mas também por um aumento na viscosidade sanguínea. A viscosidade estrutural do sangue, como um sistema disperso dinâmico complexo, é amplamente determinada pela viscosidade do plasma e pela capacidade de deformação dos eritrócitos. A viscosidade plasmática depende principalmente da concentração de proteínas no sangue. Proteínas de baixo peso molecular, como a albumina, têm pouco efeito sobre a viscosidade plasmática, enquanto proteínas de grande peso molecular (fibrinogênio, alfa e gamaglobulinas e outras macromoléculas) a aumentam significativamente.
Em baixas taxas de cisalhamento, a adsorção de fibrinogênio e globulinas na superfície dos eritrócitos leva à formação de pontes entre as células adjacentes e à formação de agregados a partir dos eritrócitos. A taxa de formação de agregados é um processo biofísico complexo e depende não apenas da magnitude do cisalhamento, mas também das propriedades eletrocinéticas dos eritrócitos, da concentração, massa e capacidade de sorção das macromoléculas agregadoras, e da forma e plasticidade dos eritrócitos.
A manutenção da forma e das propriedades mecânicas da membrana eritrocitária requer um gasto energético significativo. Acredita-se que a energia produzida nos eritrócitos durante a glicólise seja gasta na fosforilação da espectrina, o que resulta em alterações na estrutura secundária da proteína e na interação com componentes vizinhos da membrana interna. A interação entre as proteínas estruturais da membrana, espectrina e actina, desempenha um papel importante na formação das propriedades mecânicas da membrana eritrocitária, mantendo a área de superfície e a espessura do eritrócito constantes sob qualquer deformação.
Em caso de distúrbios hemodinâmicos sistêmicos e do fluxo sanguíneo de órgãos, o aumento da rigidez das membranas eritrocitárias e a formação de agregados eritrocitários levam à diminuição da taxa de passagem dos eritrócitos pelos capilares, interrompendo assim a função de transporte de gases do sangue. Portanto, a correção de distúrbios das propriedades reológicas do sangue em choque deve incluir, além da prevenção da agregação eritrocitária, a normalização da viscosidade plasmática e sanguínea, da agregação e da deformação dos eritrócitos.
Além dos dextranos de baixo peso molecular, as soluções de albumina são um dos meios eficazes para aumentar a estabilidade da suspensão sanguínea. No período tardio do choque, ocorre agregação generalizada de eritrócitos, em um contexto de diminuição da concentração de albumina no plasma sanguíneo e aumento da concentração de fibrinogênio e globulinas, especialmente da fração alfa-2, lipoproteínas e lipídios. Nessas condições, os efeitos reológicos da albumina devem-se a dois fatores principais: hemodiluição e normalização da relação entre proteínas micro e macroglobulares no plasma. Ao mesmo tempo, a albumina se liga a ácidos livres, cuja labilização durante trauma e choque estimula a agregação de estruturas celulares do sangue e a coagulação intravascular, podendo causar embolia gordurosa.
Medidas antichoque que visam repor o volume sanguíneo circulante, eliminando a hipóxia tecidual e a acidose metabólica, contribuem para a normalização da elasticidade das membranas eritrocitárias, uma vez que a hipóxia e a acidose reduzem significativamente a deformabilidade dos eritrócitos. O aumento da rigidez das membranas eritrocitárias em choque está provavelmente associado à inibição da síntese de ATP nos eritrócitos. Por sua vez, a diminuição da concentração de ATP contribui para o aumento da concentração de Ca2+ nos eritrócitos, que, ao se ligar às proteínas da membrana, aumenta a rigidez da membrana.
Um dos medicamentos farmacológicos que aumenta o conteúdo de ATP nos eritrócitos e a elasticidade das membranas dos eritrócitos é o Trental (pentoxifilina), que é usado na prática clínica para tratar distúrbios isquêmicos.
Além de reduzir a rigidez das membranas dos eritrócitos, o Trental causa vasodilatação, melhora a oxigenação dos tecidos, inibe a atividade da fosfodiesterase nos tecidos, aumenta a concentração de AMPc e inibe a agregação plaquetária.
Entre outros agentes farmacológicos que mantêm a elasticidade da membrana dos eritrócitos, vale destacar os antagonistas do Ca2+, que limitam o fluxo de íons para os eritrócitos (flunarizina, nifedipina, etc.).
 [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
[ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
Atenção!
Para simplificar a percepção da informação, esta instrução do uso da droga "Medicamentos que previnem a trombose e melhoram a reologia do sangue" traduziu e apresentou em uma forma especial com base nas instruções oficiais do uso médico da droga. Antes de usar, leia a anotação que veio diretamente para a medicação.
Descrição fornecida para fins informativos e não é um guia para a autocura. A necessidade desta droga, a finalidade do regime de tratamento, métodos e dose da droga é determinada exclusivamente pelo médico assistente. A automedicação é perigosa para a sua saúde.

