Médico especialista do artigo
Novas publicações
Glioma do cérebro
Última revisão: 07.06.2024

Todo o conteúdo do iLive é medicamente revisado ou verificado pelos fatos para garantir o máximo de precisão factual possível.
Temos diretrizes rigorosas de fornecimento e vinculamos apenas sites de mídia respeitáveis, instituições de pesquisa acadêmica e, sempre que possível, estudos médicos revisados por pares. Observe que os números entre parênteses ([1], [2], etc.) são links clicáveis para esses estudos.
Se você achar que algum dos nossos conteúdos é impreciso, desatualizado ou questionável, selecione-o e pressione Ctrl + Enter.
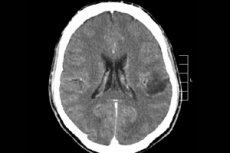
Entre os muitos processos tumorais do sistema nervoso central, o glioma cerebral é mais frequentemente diagnosticado - esse termo é coletivo, a neoplasma combina todos os focos oligodendrogliais e astrocíticos difusos, astrocitoma, astroblastoma e assim por diante. Esse tumor pode ter um grau diferente de malignidade, é formado a partir de estruturas gliais - células localizadas em torno dos neurônios. A principal área de localização dos gliomas são hemisférios cerebrais, paredes dos ventrículos cerebrais e quiasma - a área de interseção parcial das fibras do nervo óptico. Externamente, o tumor é um elemento nodular de matiz rosado ou avermelhado, configuração redonda ou em forma de fuso com limites indistintos. [1]
Epidemiologia
Em cerca de 5% dos casos, os gliomas estão associados a patologias hereditárias - em particular, neurofibromatose e outras síndromes com herança dominante. Especialistas apontam que a maioria absoluta dos gliomas cerebrais se desenvolve esporadicamente - isto é, sem uma causa clara.
No geral, as neoplasias primárias do sistema nervoso central representam aproximadamente 2% de todos os tumores, ou pouco mais de 21 casos por cem mil populações. Entre eles, os gliomas ocorrem em 35-36% dos casos, e mais de 15% deles são glioblastomas.
Segundo alguns dados, o glioma afeta os homens com mais frequência do que as mulheres - o tumor é especialmente comum entre pessoas com mais de 50 anos.
A incidência global de gliomas entre os idosos aumentou significativamente nas últimas décadas. As razões para esse fenômeno ainda não foram estabelecidas.
De acordo com a definição da Organização Mundial da Saúde, foram identificadas três principais variantes de tumores gliais, diferindo em suas características histológicas. Estes são oligodendrogliomas, astrocitomas e oligoastrocitomas combinados. A incidência de cada subtipo de baixa patologia maligna não foi determinada com segurança. Alguns estudos indicam um aumento na incidência de oligodendrogliomas de 5% para 30% e uma diminuição na incidência de astrocitomas.
Os tumores gliais são capazes de infiltrar o tecido cerebral, e a grande maioria dos focos de baixo grau se torna maligna dentro de alguns anos. [2]
Causas Gliomas cerebrais
O glioma cerebral é um grupo inteiro de processos tumorais, cuja característica comum é sua formação a partir de estruturas gliais do SNC localizado no tecido cerebral. Tais tumores são divididos em duas variantes histopatológicas: altos gliomas malignos e baixos malignos.
A fonte de formação de crescimento são as células Neuroglia (astrócitos, oligodendrócitos), que fornecem a base estrutural e a viabilidade dos neurônios cerebrais.
Os processos do tumor glial diferem muito na estrutura, mudanças mutacionais nos genes, agressividade, características clínicas, características de diagnóstico, resposta ao tratamento e prognóstico dos pacientes. Neoplasias embrionais e ependimárias do sistema nervoso central - em particular, meduloblastomas e ependimomas - diferem em sua estrutura histológica, mas são semelhantes em termos de tratamento.
Os elementos gliais foram classificados como uma categoria estrutural separada do sistema nervoso no final do século XIX.
O tecido da neuroglia consiste em células que têm funções auxiliares: tróficas, suporte, protetor, secretor. Neurônios e gliócitos existem juntos, eles juntos formam o sistema nervoso e são de grande importância nos processos gerais da atividade vital do organismo.
Os gliócitos são categorizados aproximadamente em várias formas principais: astrócitos, oligodendrócitos, células ependimais e microglia.
Até o momento, os cientistas não podem responder à pergunta sobre as causas confiáveis da formação de tumores neurogliais. Presumivelmente, uma certa contribuição negativa é feita por efeitos radioativos, doenças infecciosas, intoxicação (especialmente química, ocupacional). O fator hereditário também é importante.
Os gliomas cerebrais surgem de neurogliócitos anormais que têm um defeito genético que leva a um crescimento e funcionalidade anormais - tais estruturas são chamadas de "imaturo". As células incompletas estão mais frequentemente localizadas em uma área, onde o tumor é formado.
Simplificando, a formação glial é o resultado do crescimento caótico e esporádico de células de neuroglia modificadas. O processo pode se desenvolver a partir de ependimócitos, oligodendrócitos, astrócitos (astrocitoma, incluindo células gigantes e anaplásico). [3]
Fatores de risco
Apesar do fato de que os especialistas não podem caracterizar com precisão as causas da formação de oncopatologias gliais, em alguns casos sua aparência pode ser evitada eliminando os principais fatores de risco:
- A exposição à radiação ionizante tem atividade carcinogênica, pode causar o desenvolvimento da leucemia e a formação de processos de câncer com uma estrutura densa, inclusive em pessoas de idade jovem. Procedimentos médicos radiológicos frequentes e irracionais, a radiação ultravioleta (incluindo solário) também pertence a possíveis efeitos carcinogênicos e pode causar a aparência de tumores em vários órgãos, incluindo o cérebro.
- Efeitos adversos ocupacionais, intoxicações geralmente têm um vínculo causal com o desenvolvimento de tumores cancerosos. A produção de borracha e vidro, pesticidas e combustíveis, metais e têxteis, tintas e reagentes de laboratório é considerada particularmente perigosa. Em risco estão os trabalhadores das indústrias aeroespacial, carvão e metal, fábricas de fabricação química e subprodutos, materiais e eletrodos de construção, combustíveis e lubrificantes, plásticos e monômeros.
- O ar, a poluição do ar, da água e do solo são responsáveis por até 4% de todas as patologias do câncer no mundo. Os agentes cancerígenos, presentes em grandes quantidades no ambiente, entram no corpo com ar inalado, água potável e alimentos. Viver em áreas ecologicamente inseguras - perto de grandes instalações industriais, trocas de transporte movimentadas - é considerado especialmente perigoso.
- Patologias infecciosas - em particular infecções virais - também podem criar condições favoráveis ao desenvolvimento de tumores. É importante ter isso em mente e ser vacinado com antecedência, bem como para evitar doenças infecciosas e parasitárias.
- O tabaco e a intoxicação por álcool são considerados fatores de risco para muitas variedades de câncer, não apenas gliomas cerebrais.
- Atividade física insuficiente, sobrepeso, nutrição inadequada, distúrbios metabólicos, lesões na cabeça, patologias vasculares - fatores de estresse adicionais que podem provocar o início de distúrbios intracelulares.
- A idade avançada é o período mais comum para o desenvolvimento de neoplasias no corpo; portanto, aqueles com mais de 55 anos de idade devem cuidar especial de sua própria saúde.
No entanto, o principal e mais significativo fator de risco para o desenvolvimento do glioma permanece predisposição hereditária.
Patogênese
Até o momento, os especialistas têm várias suposições sobre o desenvolvimento de gliomas cerebrais. Cada teoria tem seus próprios motivos, mas o único mecanismo patogenético correto e confiável que os cientistas ainda não se identificaram. Na maioria dos casos, estamos falando sobre os seguintes fatores no desenvolvimento de neoplasias:
Falha na embriogênese, que consiste na interrupção da colocação de órgãos e na formação de estruturas celulares "erradas";
- Exposição a raios ionizantes, potenciais agentes cancerígenos na forma de agentes químicos, aditivos alimentares, etc.;
- Trauma da cabeça;
- Os distúrbios gênicos passaram de geração para geração (glioma "familiar");
- Disfunção imunológica, neuroinfecções.
A maioria dos gliomas tem crescimento difuso, com penetração no tecido cerebral normal circundante. Dependendo do grau de malignidade, o tumor pode se desenvolver por vários anos sem manifestação. Em caso de curso agressivo, a sintomatologia aumenta rapidamente ao longo de vários meses.
Parte da tumorigênese é devida a alterações disquedrogenéticas.
O tronco cerebral pode ser afetado em diferentes níveis: o glioma difuso do tronco cerebral, por sua vez, diferirá anatomo-morfologicamente e clinicamente. Algumas dessas neoplasias - em particular, o glioma da placa quadriplegia - podem ser relativamente benignas, sem sinais de progressão. Um glioma pontino, por outro lado, é caracterizado por sua malignidade, agressividade e mau prognóstico particular.
Lesões difusas das estruturas cerebrais, nas quais mais de três zonas anatômicas dos grandes hemisférios estão envolvidas no processo patológico, com possível divergência periventricular e passagem através do corpus chama a gliomatose. [4]
O glioma cerebral é hereditário?
Um risco bem comprovado de formação de glioma cerebral é hereditário - isto é, a presença de tumores intracerebrais semelhantes ou outros em ancestrais diretos ou na mesma geração. Exposições radioativas e contato regular ou prolongado com possíveis agentes cancerígenos exacerbam a situação.
Os gliomas não apenas podem ser herdados, mas também doenças que são acompanhadas pelo aumento do crescimento do tumor sem referência à localização-em particular, isso pode ser a neurofibromatose tipo 1 e 2, síndrome de li-fraumeni, Hippel-Lindau. Freqüentemente, nas células de glioma, são detectadas alterações em certos genes ou cromossomos.
As principais patologias associadas ao desenvolvimento de glioma em humanos são resumidas na tabela:
Patologia |
Cromossoma |
Gene |
Variedade de neoplasia |
Síndrome de Li-Fraumeni |
17ugh13 |
TR53 |
Neoplasias neuroectodérmicas, astrocitoma. |
Neurofibromatose |
17q11 |
NF1 |
Glioma do nervo óptico, astrocitoma pilocítico, neurofibromatose |
Síndrome de Turcotte |
3p21, 7p22 |
HMLH1, HPSM2 |
Astrocitoma |
Esclerose tuberosa (síndrome de Burnville). |
9T34, 16p13 |
TSC1, TSC2 |
Astrocitoma subependimal gigantocelular |
Independentemente da natureza do tumor glial, seja um caso esporádico ou uma patologia hereditária, é um distúrbio com a expressão de um gene patologicamente alterado. Além das neoplasias formadas como resultado de efeitos de aprendizagem, em outras situações, as causas das alterações genéticas permanecem incertas.
Sintomas Gliomas cerebrais
As características da sintomatologia focal dependem diretamente da área de localização do glioma cerebral e se tornam uma conseqüência de todos os tipos de distúrbios endócrinos, compressão do tecido nervoso ou processos destrutivos locais.
Se a neoplasia estiver localizada na zona parietal, uma pessoa é dominada por manifestações como convulsões, distúrbios sensoriais, deficiência auditiva.
Quando o glioma está localizado na área do hemisfério dominante, distúrbios da fala, agrafia e agnosia são detectados.
As neoplasias do lobo temporal são frequentemente acompanhadas por convulsões convulsivas, afasia, senso prejudicado no olfato e função visual e dispnéia.
Quando a pressão intracraniana aumenta, uma imagem correspondente se desenvolve com a restrição de campos visuais, paralisia dos músculos oculares e hemiplegia.
Devido à especificidade do processo tumoral, o glioma cerebral é sempre acompanhado por sintomas neurológicos em maior ou menor grau. A princípio, há uma fraqueza geral perceptível, o paciente constantemente quer dormir, a capacidade de trabalhar é prejudicada, os processos de pensamento são desacelerados. É nesta fase que existe um alto risco de fazer um diagnóstico incorreto e, como conseqüência, prescrever o tratamento errado. Entre outras manifestações inespecíficas:
- Distúrbios vestibulares, incluindo marcha instável, perda de equilíbrio (por exemplo, ao andar de bicicleta ou subir escadas), dormência nos membros, etc;
- Deterioração gradual da visão, dobrando o quadro visual;
- Deterioração da função auditiva;
- Discurso arrastado;
- Náusea e vômito na forma de ataques independentes de alimentos ou bebidas;
- Enfraquecimento dos músculos imitadores e outros músculos faciais;
- Desconforto ao engolir;
- Dores de cabeça regulares (geralmente no horário da manhã).
O quadro clínico se expande gradualmente e piora: em alguns pacientes, acontece lentamente, em outros - abruptamente, literalmente "diante de seus olhos", dentro de algumas semanas. Neste último caso, estamos falando de um glioma agressivo e rápido do cérebro.
Primeiros sinais
O glioma do cérebro nos estágios iniciais do desenvolvimento não tem uma sintomatologia pronunciada. As primeiras manifestações são frequentemente confundidas com sinais de outras patologias menos perigosas.
Em geral, a imagem clínica do glioma é diversa e é determinada pela localização e tamanho do foco patológico. À medida que a neoplasia cresce, os sintomas cerebrais gerais se desenvolvem e aumentam:
- Dores persistentes e regulares da cabeça que não respondem a medicamentos padrão (medicamentos anti-inflamatórios não esteróides);
- Náusea intermitente, às vezes ao ponto de vômito;
- Um sentimento desconfortável e pesado na área do globo ocular;
- Convulsões.
As manifestações cerebrais são especialmente intensas quando o tumor cresce nos ventrículos ou no sistema de licor. A drenagem do líquido cefalorraquidiano é prejudicada, a pressão intracraniana aumenta e a hidrocefalia se desenvolve. O processo afeta uma certa parte do cérebro, que afeta o desenvolvimento da clínica correspondente:
- Existem problemas com a função visual;
- Fala prejudicada;
- Distúrbios vestibulares (tontura, coordenação prejudicada de movimentos) ocorrem;
- Paresis, paralisia dos braços, pernas;
- Memória e concentração são prejudicadas;
- Os processos de pensamento são prejudicados;
- Os distúrbios comportamentais estão surgindo.
No estágio inicial, os sintomas estão praticamente ausentes, ou são tão insignificantes que não atraem atenção. É por esse motivo que especialistas aconselham fortemente os exames e exames preventivos regulares. Afinal, quanto mais cedo o processo tumoral for detectado, quanto maiores as chances de cura e sobrevivência. [5]
Glioma do cérebro em uma criança
Entre os muitos tumores cerebrais encontrados na infância, a porcentagem de gliomas varia de 15 a 25%. As crianças podem obter a doença no início da adolescência e no início dos vinte anos, embora seja muito raro para bebês com menos de 3 anos de idade obter a doença.
A patologia começa no fundo da mutação das células gliais. Até o momento, não há resposta para a pergunta de por que essa mutação ocorre.
A única coisa que foi aprendida de maneira confiável é que certas doenças herdadas associadas a um risco aumentado de crescimento do tumor também aumentam a probabilidade de desenvolver glioma cerebral.
Além disso, os cientistas descobriram que as células gliais podem ter divergência em genes ou cromossomos individuais. Por causa desse distúrbio, um mecanismo de mutação entra em ação, que não é hereditário. É possível que isso ocorra em um dos estágios iniciais de desenvolvimento.
É um fato comprovado que a presença de leucemia aguda ou retinoblastoma na história da criança, ou irradiação cerebral por qualquer outro motivo, aumenta significativamente os riscos da formação de glioma (após um certo período de tempo).
A sintomatologia na infância depende do grau de malignidade e localização do foco patológico. Uma distinção é feita entre sintomas específicos e inespecíficos:
- Os sintomas inespecíficos não estão "ligados" à área onde o glioma está localizado. Manifestações comuns podem incluir dor na cabeça, tontura, apetite ruim, vômito sem conexão com a ingestão de alimentos, perda de peso (por razões desconhecidas), sentimento constante de fadiga, queda no desempenho acadêmico, dificuldade em concentração, distúrbios comportamentais. Esses sinais são devidos à compressão de estruturas intracranianas, que podem ser explicadas como uma pressão direta da massa crescente e um distúrbio na circulação do líquido cefalorraquidiano. Existe um risco de hidrocele cerebral.
- A sintomatologia específica depende da localização imediata do foco patológico glial. Por exemplo, o tumor cerebelar é geralmente acompanhado de marcha e equilíbrio prejudicados em crianças. A lesão do cérebro grande se manifesta por convulsões convulsivas e o crescimento do tumor na medula espinhal - paralisia da musculatura. Acontece que a visão do bebê se deteriora acentuadamente, a consciência é perturbada, o sono é prejudicado ou ocorre algum outro problema de desenvolvimento.
Como regra, na infância, o glioma maligno se revela em algumas semanas ou meses de seu desenvolvimento: frequentemente caracterizado pelo crescimento rápido e descontrolado da neoplasia.
Crianças com tumores gliais malignos são tratados por médicos em centros clínicos pediátricos especializados em oncologia pediátrica. Como regra, são utilizados cursos de tratamento cirúrgico, radiação e quimioterapia.
A etapa de tratamento mais importante é a neurocirurgia. Quanto mais radical for, melhores as chances da criança por uma cura. Mas a intervenção cirúrgica nem sempre é possível: em particular, os problemas podem surgir com a remoção de gliomas do tronco cerebral, bem como com a radiação para crianças menores de 3 anos de idade.
Os gliomas do cérebro central (intermediário e mesencéfalo) são difíceis de remover completamente, pois há um risco de dano ao tecido saudável. Se a ressecção completa do tumor for impossível, o paciente recebe tratamento paliativo prescrito.
Crianças com gliomas malignas são tratadas de acordo com protocolos padronizados que foram determinados por meio de ensaios clínicos rigorosamente controlados. Os protocolos mais comuns são os seguintes:
- HGG HGG 2007: envolve o tratamento de crianças de 3 a 17 anos.
- HIT SKK: Adequado para bebês (até três anos de idade) e não envolve tratamentos de radiação.
As estatísticas de sobrevivência pediátrica para gliomas geralmente não são muito otimistas. No entanto, em nenhum caso, é possível prever antecipadamente a eficácia das medidas de tratamento para uma criança em particular. É importante seguir cuidadosamente todas as ordens do médico, o que aumenta significativamente as chances de recuperação.
Formulários
Os gliomas podem ser baixos e malignos e altos, com crescimento intenso e propensão a metastatizar. É importante entender que a baixa malignidade não é sinônimo de segurança do tumor. Qualquer neoplasia cerebral cria volume adicional, aperta estruturas cerebrais, o que leva ao seu deslocamento e aumento da pressão intracraniana. Como resultado, o paciente pode morrer.
Existem dois tipos principais de astrocitomas malignos. Estes são glioblastomas e astrocitomas anaplásicos, que são subdivididos de acordo com alterações moleculares. Tumores malignos secundários que se desenvolveram a partir de astrocitomas e têm um baixo grau de malignidade são mais frequentemente encontrados em pacientes jovens. Inicialmente, os tumores do tipo glial malignos ocorrem com mais frequência em pacientes idosos.
Dependendo da localização estrutural, os gliomas entram:
- Supratentorial (com localização acima do cerebelo na área de ventrículos laterais, grandes hemisférios);
- Subtentorial (com localização abaixo do cerebelo na fossa craniana posterior).
De acordo com as características histológicas, distingue esses tipos de gliomas:
- O glioma astrocítico é o mais comum. Por sua vez, é subdividido em nodular e difuso (o último pode ser caracterizado por um rápido crescimento e um padrão de acidente vascular cerebral).
- Oligodendroglioma - ocorre em 5% dos pacientes. Possui petrificados - áreas de calcificação, na maioria das vezes no lobo frontal.
- GLIOMA EPENDYMAL - Cresce das estruturas que revestem as paredes do canal central da medula espinhal e dos ventrículos. Geralmente cresce na espessura da substância cerebral, bem como no lúmen do cérebro.
Também são possíveis focos patológicos mistos, como subependimoma, oligoastrocitoma, etc.
Todos os gliomas são categorizados nos seguintes estágios:
- Neoplasias relativamente benignas de crescimento lento sem sintomas clínicos óbvios.
- Gliomas "limítrofe" de crescimento lento que gradualmente se transformam em estágio III e além.
- Glioma maligno.
- Glioma maligno com intenso crescimento e disseminação agressiva, com mau prognóstico.
Quanto menor o estágio de malignidade, menos probabilidade de metástase e recorrência da neoplasia removida e maior as chances de cura do paciente. O maior perigo é colocado pelo glioblastoma multiforme, um processo de baixa diferenciado com intensivo crescimento e desenvolvimento. [6]
Variantes possíveis e mais comuns do neuroglioma:
- O glioma com lesões no tronco cerebral e pontino está localizado na área onde o cérebro se conecta à medula espinhal. É lá que os neurocentros importantes responsáveis pela função respiratória, cardíaca e motora estão localizados. Se essa zona estiver danificada, o trabalho do aparato vestibular e de fala será perturbado. É frequentemente detectado na infância.
- O glioma visual afeta as células neurogliais que envolvem o nervo óptico. A patologia causa deficiência visual e exoftalmia. Se desenvolve com mais frequência em crianças.
- O baixo neuroglioma maligno é caracterizado por crescimento lento, localizado com mais frequência nos grandes hemisférios e cerebelo. Ocorre com mais frequência em jovens (adolescentes e adultos jovens por volta dos 20 anos de idade).
- O glioma do corpus caloso é mais característico dos indivíduos entre 40 e 60 anos de idade e é mais comumente representado pelo glioblastoma.
- O glioma do quiasma está localizado na zona de junção óptica, por isso é acompanhado por miopia, perda de campo visual, hidrocefalia oclusiva e distúrbios neuroendócrinos. Pode ocorrer em qualquer idade, mas mais comumente afeta pacientes com neurofibromatose tipo I.
Complicações e consequências
Gliomas of low malignancy (Grade I-II, highly malignant - e.g., astrocytoma, oligoastrocytoma, oligodendroglioma, pleomorphic xanthoastrocytoma, etc.) and high malignancy (Grade III-IV - glioblastoma, anaplastic oligodendroglioma, oligoastrocytoma, and astrocytoma). Os gliomas de grau IV são particularmente malignos.
O glioma do tronco cerebral tem um prognóstico muito desfavorável precisamente porque a neoplasia afeta uma região cerebral, onde as conexões nervosas mais importantes entre o cérebro e os membros estão concentradas. Mesmo um tumor bastante pequeno nessa área é suficiente para tornar a condição do paciente rapidamente se deteriorar e provocar paralisia.
Não há consequências menos desfavoráveis quando outras regiões do cérebro são afetadas. Muitas vezes, é um tumor do córtex cerebral, que não dá uma chance de uma longa expectativa de vida do paciente, apesar do tratamento. Muitas vezes, é possível adiar a morte.
De acordo com as estatísticas médicas, a taxa de sobrevivência de cinco anos é frequentemente de apenas 10 a 20%. Embora esses números dependam amplamente do grau de malignidade e da localização exata e do volume de intervenção cirúrgica realizada. Após a remoção completa do foco patológico, a taxa de sobrevivência aumenta significativamente (às vezes - até 50%). A falta de tratamento ou sua impossibilidade (por um motivo ou outro) é garantida para levar à morte do paciente.
A maioria dos tumores gliais malignos é capaz de se infiltrar no tecido cerebral e difamar ao longo de vários anos.
O risco de recorrência do glioma é considerado por especialistas como "altamente prováveis". No entanto, o tratamento não deve ser negligenciado: é importante garantir uma boa qualidade de vida pelo maior tempo possível.
Os gliomas recorrentes sempre têm um pior prognóstico do que os tumores primários. No entanto, os protocolos de tratamento modernos baseados em estudos de otimização terapêutica geralmente alcançam resultados suficientemente bons para pacientes, mesmo com neoplasias altamente malignas.
Possíveis resultados após quimioterapia:
- Emaciação, emaciação, distúrbios digestivos, doenças orais;
- Maior excitabilidade do sistema nervoso central, astenia;
- Deterioração da função auditiva, zumbido e toque nas orelhas;
- Convulsões, distúrbios depressivos;
- Crise hipertensiva, mudança no padrão sanguíneo;
- Insuficiência renal;
- Processos alérgicos, perda de cabelo, aparência de manchas de pigmento no corpo.
Após a quimioterapia, os pacientes observam um enfraquecimento pronunciado do sistema imunológico, que pode causar o desenvolvimento de várias patologias infecciosas.
Diagnósticos Gliomas cerebrais
Um glioma cerebral pode ser suspeito pelos seguintes sinais:
- O paciente localizou ou generalizou convulsões, que são características da localização cortical da neoplasia e seu lento desenvolvimento. EPI-SEIZURAS são encontradas em 80% dos pacientes com tumores gliais de baixo grau e em 30% dos pacientes com gliomas de alto grau.
- O aumento da pressão intracraniana é particularmente característica das massas localizadas nos lobos frontal e parietal direito. Associado a alta transtorno de pressão intracraniana da circulação sanguínea e da circulação de bebidas alcoólicas, implica o aparecimento de dor constante e crescente da cabeça, náusea com vômito, distúrbios visuais, sonolência. Há edema do nervo óptico, paralisia do nervo desviador. Um aumento na pressão intracraniana para valores críticos pode levar ao desenvolvimento de coma e morte. Outra causa de PIO alta é a hidrocefalia.
- O paciente tem uma imagem focal crescente. Nas formações supratentoriais, as esferas motoras e sensoriais são perturbadas, hemiopia, afasia e distúrbios cognitivos do progresso.
Se o médico suspeitar da presença de uma neoplasia cerebral, é ideal realizar ressonância magnética sem ou com a introdução do agente de contraste (gadolínio) para descobrir sua localização, tamanho e características adicionais. Se a ressonância magnética não for possível, a tomografia computadorizada é realizada e a espectroscopia de ressonância magnética é usada como método de diferenciação. Apesar da informatividade desses métodos de diagnóstico, o diagnóstico final é feito somente após a confirmação histológica durante a ressecção do foco do tumor.
Dados os critérios acima, recomenda-se iniciar o diagnóstico com um histórico completo, avaliação do status de somurológico e status funcional somato. O status neurológico é avaliado juntamente com a determinação de prováveis distúrbios intelectuais e MNEstic.
Testes de laboratório recomendados:
- Um trabalho clínico geral de sangue clínico;
- Um painel de química de sangue total;
- Micção de urina;
- Estudo de coagulação sanguínea;
- Análise para marcadores oncológicos (AFP, Beta-HCG, LDH - relevante se houver suspeita de uma lesão da zona pineal).
Para esclarecer pontos prognósticos em pacientes com glioblastoma e astrocitoma anaplásico, são avaliadas IDH1 | 2-1 mutação no gene e metilação do gene MGMT. Em pacientes com oligodendroglioma e oligoastrocitoma, é determinada 1p | 19Q Codlelation.
O diagnóstico instrumental, antes de tudo, é representado por ressonância magnética obrigatória do cérebro (às vezes - e medula espinhal). A ressonância magnética é realizada em três projeções usando os modos T1-2, Flair e T1 padrão com contraste.
Quando indicado, o ultrassom da rede vascular, ressonância magnética funcional das seções motoras e de fala, bem como angiografia, espectroscopia, Tractografia e perfusão de RM.
Investigações adicionais podem incluir:
- Eletroencefalografia do cérebro;
- Consultas com um neurocirurgião, oncologista, radiologista, oftalmologista, radiologista.
Diagnóstico diferencial
O diagnóstico diferencial é necessariamente realizado com patologias não tumorais-em particular, com hemorragia causada por malformação arterio-venosa ou arterial, bem como com processos desmielinizantes pseudotumores, doenças inflamatórias (toxoplasmose, abscesso cerebral, etc.).
Além disso, diferencie o foco do tumor primário e as metástases do sistema nervoso central.
Com os recursos modernos de ressonância magnética, é possível realizar medidas de diagnóstico com precisão o suficiente, para descobrir a origem do foco principal no SNC. A ressonância magnética do cérebro é realizada com ou sem contraste, no modo T1, T2 FLAIR - em três projeções ou fatias finas na projeção axial (modo SPGR). Esses métodos de diagnóstico permitem determinar com precisão a localização, tamanho, características estruturais da neoplasia, sua relação com a rede vascular e as áreas cerebrais próximas.
Além disso, a TC (com ou sem contraste), angiografia por tomografia computadorizada (angiografia por Sr.), Tractografia por RM, MR ou perfusão de TC podem ser realizadas como parte do diagnóstico diferencial. CT/PET do cérebro com metionina, colina, tirosina e outros aminoácidos é usada quando indicada.
Tratamento Gliomas cerebrais
A terapia específica consiste em medidas cirúrgicas, quimioterapêuticas e de radiação. É obrigatório, se possível, realizar uma ressecção completa do foco do tumor, o que permite um rápido alívio dos sintomas e confirmação histológica do diagnóstico.
A irradiação tem um efeito positivo no aumento da expectativa de vida dos pacientes. Uma dose total de 58 a 60 Gy, dividida em doses individuais de irradiação de 1,8-2 Gy, é administrada como padrão. O tumor é irradiado localmente, capturando além de 3 cm ao seu redor. A terapia de radiação é mais aceitável em oposição à braquiterapia. Em alguns casos, são recomendados métodos radiocirúrgicos, que consistem em irradiação com uma faca gama ou pedal linear, bem como terapia de boro de captura de nêutrons.
A necessidade de quimioterapia adjuvante é controversa. Em alguns casos, as preparações da nitrosoureia permitiram aumentar a expectativa de vida dos pacientes em até um ano e meio, mas alguns resultados do uso de tais quimiopreparações foram negativos. Hoje, agentes citotóxicos, terapia neoadjuvante (antes da radiação), medicamentos combinados, quimioterapia intra-arterial ou quimioterapia em altas doses com mais transplante de células-tronco são usadas ativamente.
Em geral, para o tratamento bem-sucedido dos gliomas, uma abordagem abrangente é muito importante, cuja extensão depende da localização e do grau de malignidade da massa, seu tamanho e a saúde geral do paciente.
Em relação ao glioma do tronco cerebral, a intervenção cirúrgica raramente é usada. A principal contra-indicação à cirurgia é a área de localização do foco - nas proximidades das partes vitais. Em alguns casos, é possível remover o glioma do tronco usando métodos microcirúrgicos, com quimioterapia pré-operatória e pós-operatória. Essa intervenção é muito complexa e requer qualificações especiais de um neurocirurgião.
A cirurgia de radiação e, em particular, a cirurgia estereotática com exposição a doses de alta ionização é bastante eficaz. O uso dessa técnica em estágios iniciais do desenvolvimento da neoplasia às vezes permite obter remissão prolongada ou até mesmo a cura completa do paciente.
A radiação é frequentemente combinada com quimioterapia, o que melhora a eficácia das intervenções e reduz a carga de radiação. Nos gliomas, nem todos os agentes quimiopreventivos são terapeuticamente bem-sucedidos, por isso são prescritos individualmente e as prescrições são ajustadas, se necessário.
Para reduzir a dor e diminuir a pressão intracraniana, independentemente do tratamento principal, a terapia sintomática é prescrita - em particular, medicamentos corticosteróides, analgésicos e sedativos.
Medicamentos
Os medicamentos corticosteróides afetam o inchaço, reduzem a gravidade dos sintomas neurológicos por vários dias. No entanto, devido a múltiplos efeitos colaterais e maior probabilidade de interações adversas com medicamentos quimioterapia, são utilizados doses minimamente eficazes de esteróides, interrompendo-os o mais rápido possível (por exemplo, após a cirurgia).
Os anticonvulsivantes são usados sistematicamente como uma medida preventiva secundária em pacientes que já sofreram crises epilépticas. Esses medicamentos podem causar sintomas adversos graves e também interagir com medicamentos quimioterápicos.
Os anticoagulantes são especialmente relevantes no estágio pós-operatório, uma vez que os riscos da formação de tromboflebite no glioma são bastante altos (até 25%).
Espera-se que um bom efeito tome antidepressivo-anxiolíticos. O uso do metilfenidato 10-30 mg/dia em duas doses geralmente permite otimizar as habilidades cognitivas, melhorar a qualidade de vida, manter a capacidade de trabalho.
A falha neurológica e os sinais de edema cerebral (dor na cabeça, distúrbios da consciência) são eliminados por medicamentos corticosteróides - em particular, prednisolona ou dexametasona. |
O esquema e a dose de corticosteróides são selecionados individualmente, com a prática da dose mínima eficaz. No final do curso de tratamento, os medicamentos são gradualmente retirados. |
Os corticosteróides são tomados em conjunto com medicamentos gastroprotetores-bloqueadores da bomba de prótons ou H2-histaminaBloqueadores. |
Diuréticos (furosemida, manitol) são prescritos para inchaço grave e deslocamento das estruturas cerebrais, como um complemento para medicamentos corticosteróides. |
No caso de crises convulsivas (incluindo anamnese) ou sintomas epileptiformes no eletroencefalograma, a terapia anticonvulsivante é prescrita adicionalmente. Os anticonvulsivantes não são prescritos para fins profiláticos. |
Recomenda-se que pacientes com indicações para quimioterapia tomem anticonvulsivantes que não afetam a função da enzima hepática. Drogas de escolha: lamotrigina, ácido valpróico, levetiracetam. Não deve ser usado: carbamazepina, fenobarbital. |
A dor na cabeça nos gliomas cerebrais é gerenciada com tratamento com corticosteróide. |
Em alguns casos de dores de cabeça, medicamentos anti-inflamatórios não esteróides ou tramadol podem ser usados. |
Se o paciente estiver tomando medicamentos anti-inflamatórios não esteróides, ele é interrompido alguns dias antes da cirurgia para minimizar a chance de sangramento durante a cirurgia. |
Em casos de dor selecionados, analgésicos narcóticos - como fentanil ou triperidina - podem ser recomendados. |
Para evitar a embolia pulmonar do terceiro dia pós-operatório, é prescrita a administração de heparinas de baixo peso molecular - em particular, a enoxaparina sódica ou cálcio de nadroparina - é prescrita. |
Se o paciente estiver em tratamento anticoagulante sistemático ou antiaggant, ele é transferido para heparinas de baixo peso molecular o mais tardar uma semana antes da intervenção cirúrgica, com sua retirada adicional um dia antes da cirurgia e retomada 24-48 horas após a cirurgia. |
Se um paciente com glioma tem trombose venosa das extremidades inferiores, o tratamento com anticoagulantes diretos é realizado. A possibilidade de colocar um filtro de cava não é excluída. |
Quimioterapia para gliomas malignos do cérebro
Os regimes básicos de quimioterapia antitumoral para gliomas são considerados:
- Lomustina 100 mg/m² No primeiro dia, Vinncristina 1,5 mg/m² nos dias um e oito, procarbazina 70 mg/m² do dia oito a vigésimo primeiro, os cursos a cada seis semanas.
- Lomustina 110 mg/m² a cada seis semanas.
- Temozolomida 5/23 150 a 200 mg/m² do dia um ao dia cinco, a cada 28 dias.
- Temozolomida como parte do tratamento da quimiorradiação, 75 mg/m² todos os dias essa radiação é dada.
- Temozolomida com cisplatina ou carboplatina (80 mg/m²) e temozolomida 150-200 mg/m² nos dias 1 a 5 a cada 4 semanas.
- A temozolomida 7/7 a 100 mg/m² nos dias 1-8 e 15-22 do curso, com uma repetição a cada quatro semanas.
- Bevacizumabe 5 a 10 mg/kg nos dias um e quinze, e irinotecano 200 mg/m² nos dias um e quinze, repetidos a cada quatro semanas.
- Bevacizumabe 5 a 10 mg/kg nos dias um, quinze e vinte e nove, e lomustina 90 mg/m² no dia um a cada seis semanas.
- Bevacizumabe 5 a 10 mg/kg nos dias um e quinze, Lomustina 40 mg nos dias um, oito, quinze e vinte e dois, repetidos a cada seis semanas.
- Bevacizumabe 5 a 10 mg/kg nos dias um e quinze, repetidos a cada quatro semanas.
Drogas citostáticas em muitos casos inibem com sucesso o crescimento de células tumorais, mas não mostram seletividade em relação a tecidos e órgãos saudáveis. Portanto, especialistas identificaram várias contra-indicações nas quais a quimioterapia do glioma é impossível:
- Sensibilidade individual excessiva aos agentes quimiopreventivos;
- Descompensação da função cardíaca, renal e hepática;
- Hematopoiese deprimida na medula óssea;
- Problemas de função adrenal.
A quimioterapia é administrada com extrema cautela:
- Pacientes com distúrbios significativos do ritmo cardíaco;
- Com diabetes;
- Para infecções virais agudas;
- Para pacientes idosos;
- Pacientes que sofrem de alcoolismo crônico (intoxicação por álcool crônico).
O efeito colateral mais grave dos medicamentos quimiopreventivos é sua toxicidade: os citostáticos interferem seletivamente na funcionalidade das células sanguíneas e mudam sua composição. Como conseqüência, a massa de plaquetas e eritrócitos diminui e a anemia se desenvolve.
Antes de prescrever um paciente um curso de quimioterapia, o médico sempre leva em consideração o grau de toxicidade dos medicamentos e as complicações prováveis após seu uso. Os cursos de quimioterapia são sempre cuidadosamente monitorados por especialistas e monitoramento regular de sangue.
Possíveis consequências da terapia citostática:
- Gantness, emaciação;
- Dificuldade em engolir alimentos, membranas mucosas secas, periodontite, dispepsia;
- Instabilidade do sistema nervoso central, distúrbios maníacos-depressivos, síndrome de convulsão, astenia;
- Deterioração da função auditiva;
- Aumento da pressão arterial até o desenvolvimento da crise hipertensiva;
- Diminuição das plaquetas, glóbulos vermelhos, glóbulos brancos, hemorragias múltiplas, sangramento interno e externo;
- Insuficiência renal;
- Processos alérgicos;
- Perda de cabelo, aparecimento de áreas de aumento da pigmentação.
Após os cursos de quimioterapia, os pacientes têm um risco aumentado de desenvolver doenças infecciosas, e a dor muscular e articular é comum.
Para reduzir o risco de efeitos pós-qumoterapêuticos adversos, são necessariamente prescritas medidas de reabilitação, cujo objetivo é restaurar o contorno normal, a estabilização da atividade cardiovascular, a normalização do status neurológico. O apoio psicológico suficiente é necessariamente praticado.
Tratamento cirúrgico
A cirurgia é realizada para remover o foco do tumor o máximo possível, o que, por sua vez, deve reduzir a pressão intracraniana, reduzir a insuficiência neurológica e fornecer o biomaterial necessário para a pesquisa.
- A cirurgia é realizada em um departamento ou clínica neurocirúrgica especializada cujos especialistas têm experiência em intervenções neuro-oncológicas.
- O cirurgião realiza acesso por trepanação de osso de plástico na área de suspeita de localização de glioma.
- Se a neoplasia estiver localizada anatomicamente perto de áreas ou vias motoras, ou nos núcleos ou ao longo dos nervos cranianos, o monitoramento neurofisiológico intraoperatório é usado.
- Sistemas de neuronavigação, navegação por fluorescência intraoperatória com ácido 5-aminolevulênico é desejável para maximizar a remoção da neoplasia.
- Após a intervenção, uma TC ou RM de controle (com ou sem injeção de contraste) é realizada no dia 1-2.
Se a ressecção cirúrgica do glioma for impossível ou inicialmente reconhecida como inadimplente, ou se houver suspeita de linfoma do sistema nervoso central, é realizada uma biópsia (aberta, estereotática, com monitoramento de navegação etc.). |
Pacientes com gliomatose cerebral são verificados por biópsia estereotática, uma vez que as táticas terapêuticas dependem amplamente do quadro histológico. |
Em certas situações - em pacientes idosos, em caso de distúrbios neurológicos graves, em caso de localização de glioma no tronco e em outras partes vitais - o tratamento é planejado com base nos sintomas e informações de imagem após uma consulta médica geral. |
Pacientes com astrocitoma pilóide, bem como formas nodulares de neoplasias do tronco cerebral e processos exofíticos, são recomendados para passar por ressecção ou biópsia aberta. |
Pacientes com glioma pontino difuso e outras neoplasias difusas do tronco são tratadas com radiação e terapia medicamentosa antitumoral. A verificação não é necessária nesses casos. |
Pacientes com glioma de placa quadriplégico sofrem ressonância magnética sistemática e monitoramento clínico após a remoção da hidrocele cerebral. Se a neoplasia mostrar sinais de crescimento, ela será removida com irradiação adicional. |
Quando a ressecção parcial ou a biópsia de um glioma maligno de baixo grau é realizado, pacientes com dois ou mais fatores de risco são necessariamente tratados com radiação e/ou quimioterapia. |
A ressecção total é obrigatória para pacientes com astrocitoma celular gigante subependimal. |
O everolimus é prescrito para o astrocitoma celular gigante subependimal difuso. |
O astrocitoma pilóide deve ser removido com ressonância magnética após intervenção para esclarecer a qualidade da ressecção radical do tecido tumoral. |
No glioblastoma, a terapia pós-operatória deve ser combinada (radiação + quimioterapia) com administração de temozolomida. |
No astrocitoma anaplásico após a cirurgia, é indicada terapia com radiação com terapia medicamentosa adicional. Lomustina, temozolomida são usadas. |
Pacientes com oligodendroglioma anaplásico ou oligoastrocitoma recebem radiação e quimioterapia (temozolomida ou monoterapia com PCV) após a cirurgia. |
Pacientes idosos com extenso glioma alto maligno são irradiados no modo hipofracionado, ou a monoterapia com temozolomida é realizada. |
No caso de recorrência do glioma, a possibilidade de reoperação e subsequente táticas de tratamento são discutidas por um consilium de especialistas. O regime ideal para recorrências: reoperação + quimioterapia sistêmica + exposição a radiação repetida + medidas paliativas. Se houver áreas menores localizadas de crescimento recorrente do tumor, poderão ser utilizadas radiocirurgia. |
Os medicamentos de escolha para o crescimento recorrente do glioma são temozolomida e bevacizumab. |
A recorrência de oligodendrogliomas altamente malignos e astrocitomas anaplásicos é uma indicação para o tratamento com temozolomida. |
O xantoastocitoma pleomórfico é removido sem quimioterapia adjuvante obrigatória. |
Uma das peculiaridades dos gliomas é a dificuldade em seu tratamento e remoção. O cirurgião pretende remover os tecidos da neoplasia o mais completamente possível, para obter compensação da condição. Muitos pacientes são capazes de melhorar a qualidade de vida e prolongá-la, mas para tumores altamente malignos, o prognóstico permanece desfavorável: há uma maior probabilidade de re-crescimento do foco patológico.
Nutrição para glioma do cérebro
Dieta para pacientes com tumores malignos - um ponto importante, que, infelizmente, muitas pessoas não prestam muita atenção. Enquanto isso, graças às mudanças na dieta, é possível desacelerar o desenvolvimento do glioma e fortalecer e abalar a imunidade.
Principais áreas de mudança alimentar:
- Normalização de processos metabólicos, fortalecendo a proteção imunológica;
- Desintoxicação do corpo;
- Otimização do potencial energético;
- Garantir o funcionamento normal de todos os órgãos e sistemas do corpo durante um período tão difícil para eles.
É necessária uma dieta racional e equilibrada, pois pacientes com estágios iniciais de baixas neoplasias malignas e pacientes com a última etapa do glioblastoma. A dieta cuidadosamente selecionada contribui para a melhoria do bem-estar geral, a recuperação de tecidos danificados, o que é especialmente importante contra os antecedentes do tratamento citostático e de radiação. O equilíbrio de componentes nutricionais e processos metabólicos adequados impedem a formação de focos infecciosos, bloqueiam as reações inflamatórias, a exaustão do corpo.
Os seguintes alimentos e bebidas são recomendados para o glioma cerebral:
- Frutas e vegetais de cor vermelha, amarela e laranja (tomate, pêssegos, damascos, cenoura, beterraba, frutas cítricas) contendo carotenóides, que protegem células saudáveis dos efeitos negativos da terapia de radiação;
- Couve (couve-flor, brócolis, couve de Bruxelas), rabanete, mostarda e outros produtos vegetais que contêm indol - uma substância ativa que neutraliza os fatores tóxicos e químicos adversos;
- Verdes (endro, salsa, leão jovem e urtiga, ruibarbo, rúcula, espinafre), ervilhas verdes e aspargos, feijões de aspargos e algas (algas marinhas, espirulina, Chlorella);
- Chá verde;
- Alho, cebola, abacaxi, que têm capacidade antitumoral e desintoxicante;
- Farelo, cereais, pão integral, brotos de legumes, grãos e sementes;
- Graças escuras, framboesas, morangos e morangos, mirtilos, amoras, romã, grossos, grãos negros, rowanberries, mirtilos, buckthorn, cerejas e outras bagas que contêm antioxidantes naturais que reduzem os efeitos negativos de radicais livres, vírus, vírus e carcinistas naturais;
- Produtos lácteos com baixo teor de gordura.
Você não deve sobrecarregar o sistema digestivo e todo o corpo com alimentos pesados e gordurosos. É útil usar sucos caseiros, smoothies e pedaços espremidos na hora. Fontes de ácidos graxos ômega-3, como óleo de peixe, óleo de linhaça ou sementes de linho, devem ser adicionados aos pratos.
É melhor evitar o açúcar e os doces. Mas uma colher de mel com uma xícara de água não vai doer: os produtos de abelha têm um efeito anti-inflamatório, antioxidante e antitumoral pronunciado. A única contra-indicação ao uso do mel é uma alergia ao produto.
Da dieta deve ser excluída:
- Carne, banha, miudezas;
- Manteiga, laticínios gordurosos;
- Carne defumada, salsichas, carne enlatada e peixe;
- Álcool de qualquer forma;
- Doces, doces, bolos e doces, doces e chocolates;
- Alimentos de conveniência, fast food, lanches;
- Alimentos fritos.
Você deve consumir vegetais, verduras, frutas e água potável e limpeza diariamente.
Durante a quimioterapia e, por algum tempo depois, você deve beber sucos caseiros de vegetais e frutas, comer queijo cottage caseiro com pouca gordura, leite e queijo. É importante beber muitos líquidos, escovar os dentes e enxaguar a boca com frequência (cerca de 4 vezes por dia).
Refeições ideais para pacientes com glioma cerebral:
- Caçarolas vegetais;
- Acompanhamentos e sopas feitas de cereais (de preferência trigo sarraceno, aveia, arroz, cuscuz, bulgur);
- Cheesecakes, pudins, caçarolas no vapor;
- Vegetais cozidos e assados;
- Ensopados, sopas de vegetais, primeiro e segundo pratos de leguminosas (incluindo soja), patês e suflés;
- Smoothies, chá verde, compostos e pedaços.
Prevenção
Se uma pessoa leva um estilo de vida saudável e, entre seus parentes, não houve casos de patologia do câncer, ela tem todas as chances de não obter glioma cerebral. Não há prevenção específica de tais tumores; portanto, os principais pontos preventivos são considerados nutrição adequada, atividade física, prevenção de maus hábitos, ausência de riscos ocupacionais e domésticos.
Especialistas fornecem uma série de recomendações simples, mas eficazes:
- Beba mais água pura, evite refrigerantes adoçados, sucos embalados, bebidas energéticas e álcool.
- Evite riscos ocupacionais e domésticos: menos contato com produtos químicos, soluções corrosivas e líquidos.
- Tente preparar comida fervendo, estufando, assando, mas não fritando. Dê preferência a alimentos caseiros saudáveis e de qualidade.
- Uma grande proporção de sua dieta deve ser alimentos vegetais, incluindo verduras, independentemente da época do ano.
- Outro fator negativo está sendo acima do peso, que deve ser se livrado. O controle de peso é muito importante para a saúde de todo o corpo.
- Os óleos vegetais devem sempre ser preferidos sobre manteiga e banha.
- Se possível, é desejável dar preferência a produtos ecológicos, carne sem hormônios, vegetais e frutas sem nitratos e pesticidas. É melhor evitar a carne vermelha completamente.
- Não tome preparações multivitamínicas sem indicações e em grandes quantidades. Não tome nenhum medicamento sem receita médica: a autodedicação é muitas vezes muito, muito perigosa.
- Se os sintomas suspeitos aparecerem, é necessário visitar um médico, sem esperar o agravamento da situação, o desenvolvimento de efeitos e complicações adversos.
- Doces e alimentos com alto índice glicêmico são um componente indesejável da dieta.
- Quanto mais cedo uma pessoa vai para os médicos, melhores suas chances de cura (e isso se aplica a quase qualquer doença, incluindo o glioma do cérebro).
Para evitar a formação de oncopatologia, você precisa de tempo suficiente para dormir e descansar, evite o consumo excessivo de bebidas alcoólicas, prefere alimentos naturais de alta qualidade, reduza o uso de aparelhos (em particular, os telefones celulares).
As doenças tumorais geralmente ocorrem em idosos e idosos. Portanto, é importante monitorar sua própria saúde desde tenra idade e não provocar processos patológicos por estilo de vida prejudicial e hábitos prejudiciais.
As causas exatas da oncologia ainda não foram esclarecidas. No entanto, um certo papel, é claro, desempenha condições ocupacionais e ambientais desfavoráveis, exposição à radiação ionizante e eletromagnética, alterações hormonais. Não fique muito tempo e regularmente sob o sol, permita mudanças repentinas na temperatura ambiente, superaquecem no banho ou sauna, geralmente tomam banhos ou chuveiros quentes.
Outra pergunta: como impedir uma recorrência do glioma cerebral após seu tratamento bem-sucedido? A recorrência do crescimento da neoplasia é um complexo e, infelizmente, complicações frequentes, o que é difícil de prever com antecedência. Os pacientes podem ser recomendados para se submeter a exames e exames preventivos regulares, visitar um oncologista e assistir ao médico pelo menos duas vezes por ano, levar um estilo de vida saudável, comer alimentos saudáveis e naturais, praticar atividade física moderada. Outra condição é o amor pela vida, otimismo saudável, atitude positiva em relação ao sucesso em qualquer circunstância. Isso também inclui uma atmosfera amigável na família e no trabalho, paciência e apoio incondicional de pessoas próximas.
Previsão
A condição do cérebro e as características do glioma no momento de sua detecção influenciam a taxa de sobrevivência tanto quanto o tratamento administrado. Uma saúde geral satisfatória do paciente e sua idade melhoram o prognóstico (o prognóstico é mais otimista em pacientes jovens). Um indicador importante é a imagem histológica da neoplasia. Assim, os gliomas de baixo grau têm um melhor prognóstico do que os gliomas anaplásicos e, ainda mais, glioblastomas (os processos de tumor mais desfavoráveis). Os astrocitomas têm um pior prognóstico do que os oligodendrogliomas.
Os astrocitomas malignos respondem mal à terapia e têm uma taxa de sobrevivência relativamente baixa de seis a cinco anos. Ao mesmo tempo, a expectativa de vida em gliomas de baixo grau é estimada em 1 a 10 anos.
Os astrocitomas malignos são essencialmente incuráveis. A direção do tratamento geralmente envolve reduzir as manifestações neurológicas (incluindo disfunção cognitiva) e aumentar a expectativa de vida, mantendo a maior qualidade de vida possível. A terapia sintomática é atraída contra os antecedentes das medidas de reabilitação. O trabalho de um psicólogo também é importante.
Na última década, os cientistas fizeram algum progresso para entender a natureza dos tumores cerebrais e como tratá-los. Muito mais deve ser feito para otimizar o prognóstico da doença. A principal tarefa dos especialistas hoje é o seguinte: o glioma cerebral deve ter vários esquemas para a eliminação efetiva do problema de uma só vez, tanto em estágios iniciais quanto subsequentes de desenvolvimento.

