Médico especialista do artigo
Novas publicações
Causas e patogénese da difteria
Última revisão: 04.07.2025

Todo o conteúdo do iLive é medicamente revisado ou verificado pelos fatos para garantir o máximo de precisão factual possível.
Temos diretrizes rigorosas de fornecimento e vinculamos apenas sites de mídia respeitáveis, instituições de pesquisa acadêmica e, sempre que possível, estudos médicos revisados por pares. Observe que os números entre parênteses ([1], [2], etc.) são links clicáveis para esses estudos.
Se você achar que algum dos nossos conteúdos é impreciso, desatualizado ou questionável, selecione-o e pressione Ctrl + Enter.
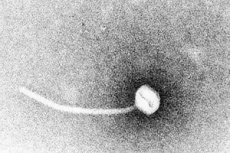
A difteria é um paradigma das doenças infecciosas toxigênicas. Em 1883, Klebs demonstrou que Corynebacterium diphtheriae era o agente causador da difteria. Um ano depois, Loeffler descobriu que o organismo só podia ser cultivado na cavidade nasofaríngea e propôs que o dano aos órgãos internos se devia a uma toxina solúvel. Em 1888, Roux e Yersin demonstraram que animais injetados com filtrados estéreis de C. diphtheriae desenvolveram patologia orgânica indistinguível daquela da difteria humana; isso demonstrou que uma exotoxina potente era o principal fator de virulência.
A difteria é, na maioria das vezes, uma infecção do trato respiratório superior que causa febre, dor de garganta e mal-estar. Uma membrana espessa de fibrina, verde-acinzentada, uma pseudomembrana, frequentemente se forma no(s) local(is) da infecção como resultado dos efeitos combinados do crescimento bacteriano, produção de toxinas, necrose do tecido subjacente e resposta imune do hospedeiro. O reconhecimento de que o dano sistêmico aos órgãos é devido à ação da toxina diftérica levou ao desenvolvimento de uma terapia eficaz à base de antitoxina para o tratamento da infecção aguda e de uma vacina toxoide altamente eficaz.
Embora a imunização com toxoide tenha tornado a difteria uma doença rara em áreas onde os padrões de saúde pública exigem a vacinação, surtos de difteria ainda ocorrem em grupos não imunizados e imunocomprometidos. Em contraste, surtos generalizados de difteria, atingindo proporções epidêmicas, ocorreram em áreas onde os programas de imunização ativos foram suspensos.
Outros tipos de corinebactérias
Além de C. diphtheriae, C. ulcerans e C. pseudotuberculosis, C. pseudodiphtheriticum e C. xerosis podem ocasionalmente causar infecções nasofaríngeas e cutâneas. As duas últimas cepas são reconhecidas por sua capacidade de produzir pirazinamidase. Na medicina veterinária, C. renale e C. kutscheri são patógenos importantes, causando pielonefrite em bovinos e infecções latentes em camundongos, respectivamente.
Causas
O agente causador da difteria, Corynebacterium diphtheriae, é um bastonete fino, ligeiramente curvado, com espessamentos em forma de clava nas extremidades, imóvel; não forma esporos, cápsulas ou flagelos e é gram-positivo.
Além da toxina, as corinebactérias diftéricas produzem neuraminidase, hialuronidase, hemolisina, fatores necrosantes e difusos durante seus processos vitais, que podem causar necrose e liquefação da principal substância do tecido conjuntivo.
Com base na sua capacidade de formar toxinas, as corinebactérias diftéricas são divididas em toxigênicas e não toxigênicas.
A toxina diftérica é uma exotoxina bacteriana potente que determina as manifestações clínicas gerais e locais da doença. A toxigenicidade é determinada geneticamente. Corinebactérias diftéricas não toxigênicas não causam a doença.
De acordo com características culturais e morfológicas, todas as corinebactérias diftéricas são divididas em 3 variantes: gravis, mitis e intermedius. Não há dependência direta da gravidade da doença em relação à variante da corinebactéria diftérica. Cada variante contém cepas toxigênicas e não toxigênicas. As corinebactérias toxigênicas de todas as variantes produzem uma toxina idêntica. [ 1 ]
Estrutura, classificação e tipos de antígenos
Corynebacterium diphtheriae é um bastonete Gram-positivo, imóvel e em forma de clava. Cepas cultivadas em tecidos ou em culturas in vitro mais antigas contêm finas manchas nas paredes celulares que permitem a descoloração durante a coloração de Gram e resultam em uma reação de Gram variável. Culturas mais antigas frequentemente contêm grânulos metacromáticos (polimetafosfato) que se coram em roxo-azulado com azul de metileno. Os açúcares da parede celular incluem arabinose, galactose e manose. Além disso, o tóxico 6,6'-éster da trealose pode ser isolado, contendo os ácidos corinemicólico e corinemicolênico em concentrações equimolares. Três tipos distintos de cultura são reconhecidos: mitis, intermedius e gravis.
A maioria das cepas requer ácidos nicotínico e pantotênico para o crescimento; algumas também requerem tiamina, biotina ou ácido pimélico. Para a produção ideal da toxina diftérica, o meio deve ser suplementado com aminoácidos e deve ser mantido em repouso.
Já em 1887, Loeffler descreveu o isolamento de C. diphtheriae avirulento (não toxigênico) que eram indistinguíveis de cepas virulentas (toxigênicas) isoladas de pacientes em indivíduos saudáveis. Atualmente, reconhece-se que cepas avirulentas de C. diphtheriae podem ser convertidas em um fenótipo virulento após infecção e lisogenização por um dentre vários corinebacteriófagos distintos portadores do gene estrutural da toxina diftérica, tox. A conversão lisogênica do fenótipo avirulento em virulento pode ocorrer tanto in situ quanto in vitro. O gene estrutural da toxina diftérica não é essencial nem para o corinebacteriófago nem para o C. diphtheriae. Apesar dessa observação, a deriva genética da toxina diftérica não foi observada.
Patogênese
Os pontos de entrada da infecção são as membranas mucosas da orofaringe, nariz, laringe e, menos frequentemente, a membrana mucosa dos olhos e genitais, bem como pele lesionada, superfícies de feridas ou queimaduras, assaduras e feridas umbilicais não cicatrizadas. No ponto de entrada, a bactéria difteria corynebacterium se multiplica e secreta exotoxina.
O exsudato rico em fibrinogênio é exsudado e convertido em fibrina sob a influência da tromboquinase liberada durante a necrose das células epiteliais. Forma-se uma película fibrinosa – um sinal característico da difteria.
A presença assintomática na nasofaringe é comum em regiões endêmicas de difteria. Em indivíduos suscetíveis, cepas toxigênicas causam a doença replicando-se e secretando a toxina diftérica na nasofaringe ou em lesões cutâneas. A lesão diftérica é frequentemente revestida por uma pseudomembrana composta de fibrina, bactérias e células inflamatórias. A toxina diftérica pode ser clivada proteoliticamente em dois fragmentos: fragmento A N-terminal (domínio catalítico) e fragmento B (domínios transmembrana e de ligação ao receptor). O fragmento A catalisa a ADP-ribosilação dependente de NAD+ do fator de alongamento 2, inibindo assim a síntese proteica em células eucarióticas. O fragmento B liga-se a um receptor de superfície celular e facilita a entrega do fragmento A ao citosol.
A imunidade protetora envolve a resposta de anticorpos à toxina diftérica após doença clínica ou à toxina diftérica (toxina inativada pelo formaldeído) após a imunização.
Colonização
Pouco se sabe sobre os fatores que mediam a colonização de C. diphtheriae. No entanto, é evidente que outros fatores além da produção da toxina diftérica contribuem para a virulência. Estudos epidemiológicos demonstraram que um determinado lisotipo pode persistir em uma população por longos períodos de tempo. Ele pode posteriormente ser substituído por outro lisotipo. O surgimento e a subsequente dominância de um novo lisotipo em uma população estão presumivelmente relacionados à sua capacidade de colonizar e competir efetivamente em seu segmento do nicho ecológico nasofaríngeo. Corynebacterium diphtheriae pode produzir neuraminidase, que cliva o ácido siálico da superfície celular em seus componentes piruvato e ácido N-acetilneuramínico. O fator corda (6,6'-di-O-micoloil-α, α'-D-trealose) é um componente de superfície de C. diphtheriae, mas seu papel na colonização do hospedeiro humano não é claro.
Produção de toxinas diftéricas
O gene estrutural da toxina diftérica, tox, pertence a uma família de corinebacteriófagos intimamente relacionados, dos quais o β-fago é o mais bem estudado. A regulação da expressão da toxina diftérica é mediada por um repressor ativado por ferro, DtxR, codificado pelo genoma de C. diphtheriae. A expressão da toxina depende do estado fisiológico de C. diphtheriae. Sob condições nas quais o ferro se torna o substrato limitante da taxa de crescimento, o ferro se dissocia do DtxR, o gene do toxicodendro é ativado e a toxina diftérica é sintetizada e secretada no meio de cultura em taxas máximas.
A toxina diftérica é excepcionalmente potente; para espécies suscetíveis (por exemplo, humanos, macacos, coelhos, porquinhos-da-índia), doses tão baixas quanto 100 a 150 ng/kg de peso corporal são letais. A toxina diftérica consiste em uma única cadeia polipeptídica de 535 aminoácidos. Análises bioquímicas, genéticas e de raios-X mostram que a toxina consiste em três domínios estruturais/funcionais:
- ADP-ribosiltransferase N-terminal (domínio catalítico);
- uma região que facilita a entrega do domínio catalítico através da membrana celular (domínio transmembrana);
- domínio de ligação ao receptor de células eucarióticas.
Após digestão moderada com tripsina e redução sob condições desnaturantes, a toxina diftérica pode ser clivada especificamente em sua alça sensível à protease em dois fragmentos polipeptídicos (A e B). O fragmento A é o componente N-terminal de 21 kDa da toxina e contém o sítio catalítico para a ADP-ribosilação do fator de alongamento 2 (EF-2).
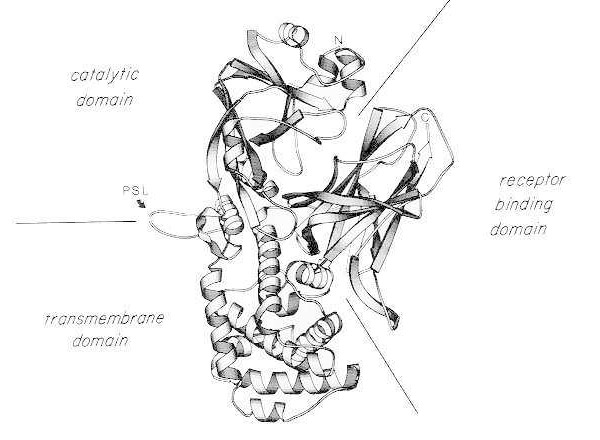
Diagrama de fita da estrutura cristalina de raios X da toxina diftérica nativa monomérica. (modificado de Bennett MJ, Choe S, Eisenberg D: Domain swapping: Entangling aliances between proteins. Proc Natl Acad Sci, EUA, 91: 3127, 1994). As posições relativas dos domínios catalítico, transmembrana e de ligação ao receptor são mostradas. A toxina intacta pode ser clivada por proteases semelhantes à tripsina em Arg190, Arg192 e/ou Arg193, que estão localizadas na alça sensível à protease (PSL). Após a redução da ponte dissulfeto entre Cys186 e Cys201, a toxina pode ser dissociada em fragmentos A e B. O terminal amino (N) e o terminal carboxílico (C) da toxina intacta são mostrados. O diagrama de fita foi criado usando o programa MOLESCRIPT.
O fragmento C-terminal, fragmento B, carrega os domínios transmembrana e de ligação ao receptor da toxina.
O envenenamento de uma única célula eucariótica pela toxina diftérica envolve pelo menos quatro etapas distintas:
- ligação da toxina ao seu receptor na superfície celular;
- agrupamento de receptores carregados em cavidades revestidas e internalização da toxina via endocitose mediada por receptor; após acidificação da vesícula endocítica por uma bomba de prótons acionada por ATP e associada à membrana,
- inserção do domínio transmembranar na membrana e entrega facilitada do domínio catalítico no citosol, e
- ADP-ribosilação de EF-2, resultando na supressão irreversível da síntese de proteínas.
Foi demonstrado que uma única molécula do domínio catalítico liberada no citosol é suficiente para ser letal para a célula.
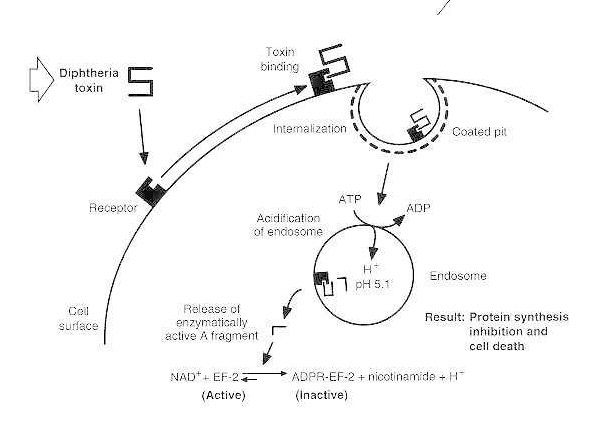
Diagrama esquemático da intoxicação por difteria de uma célula eucariótica suscetível.
A toxina se liga ao seu receptor de superfície celular e é internalizada via endocitose mediada por receptor; após a acidificação do endossomo, o domínio transmembrana é inserido na membrana da vesícula; o domínio catalítico é entregue ao citosol, levando à inibição da síntese de proteínas e morte celular.
Epidemiologia
Antes da imunização em massa da população dos EUA com toxoide diftérico, a difteria era geralmente uma doença infantil. Um aspecto notável da imunização em massa com toxoide diftérico é que, à medida que a porcentagem da população com níveis protetores de imunidade antitoxina (≥ 0,01 UI/mL) aumenta, a frequência de isolamento de cepas toxigênicas da população diminui. Hoje, nos Estados Unidos, onde a difteria clínica desapareceu quase completamente, o isolamento de cepas toxigênicas de C. diphtheriae é raro. Como a infecção subclínica não fornece mais uma fonte de exposição ao antígeno diftérico e, a menos que seja reforçada, a imunidade à antitoxina diminui, uma grande porcentagem de adultos (30 a 60%) tem níveis de antitoxina abaixo dos níveis protetores e está em risco. Nos Estados Unidos, Europa e Leste Europeu, surtos recentes de difteria ocorreram principalmente entre indivíduos que abusam de álcool e/ou drogas. Dentro deste grupo, os portadores de C. diphtheriae toxigênica apresentam um nível moderadamente alto de imunidade antitóxica. O recente colapso das medidas de saúde pública na Rússia fez com que a difteria se tornasse uma epidemia. Até o final de 1994, mais de 80.000 casos e mais de 2.000 mortes haviam sido relatados na Rússia.
Surtos focais de difteria são quase sempre associados a um portador imunológico que retornou de uma região onde a difteria é endêmica. De fato, surtos recentes de difteria clínica nos Estados Unidos e na Europa foram associados a viajantes que retornaram da Rússia e da Europa Oriental. Cepas toxigênicas de C. diphtheriae são transmitidas diretamente de pessoa para pessoa por gotículas transportadas pelo ar. Sabe-se que cepas toxigênicas podem colonizar diretamente a cavidade nasofaríngea. Além disso, o gene toxigênico pode ser disseminado indiretamente pela liberação de corinebacteriófago toxigênico e transformação lisogênica de C. diphtheriae autóctone não toxigênico in situ. [ 5 ]
Além da determinação do biótipo e do lisotipo de isolados de C. diphtheriae, técnicas de biologia molecular agora podem ser usadas para estudar surtos de difteria. Padrões de digestão por endonucleases de restrição do DNA cromossômico de C. diphtheriae têm sido usados para estudar surtos clínicos, assim como o uso de sequências de inserção clonadas de corinebactérias como sonda genética.
O teste de Schick tem sido usado por muitos anos para avaliar a imunidade à toxina diftérica, embora tenha sido substituído em muitas áreas pelo teste sorológico para anticorpos específicos à toxina diftérica. No teste de Schick, uma pequena quantidade de toxina diftérica (aproximadamente 0,8 ng em 0,2 ml) é injetada intradermicamente no antebraço (local de teste) e 0,0124 μg de toxina diftérica em 0,2 ml é injetado intradermicamente no local de controle. As leituras são feitas em 48 e 96 horas. As reações cutâneas inespecíficas geralmente atingem o pico em 48 horas. Em 96 horas, uma reação eritematosa com alguma possível necrose no local do teste indica imunidade antitóxica insuficiente para neutralizar a toxina (≤ 0,03 UI/ml). A inflamação nas áreas de teste e controle após 48 horas indica uma reação de hipersensibilidade à preparação do antígeno.
Formulários
Corynebacterium diphtheriae infecta a nasofaringe ou a pele. Cepas toxigênicas produzem uma exotoxina potente que pode causar difteria. Os sintomas da difteria incluem faringite, febre e inchaço do pescoço ou da área ao redor da lesão cutânea. As lesões diftéricas são cobertas por uma pseudomembrana. A toxina se espalha pela corrente sanguínea para órgãos distantes e pode causar paralisia e insuficiência cardíaca congestiva. [ 6 ]
Existem dois tipos de difteria clínica: nasofaríngea e cutânea. Os sintomas da difteria faríngea variam de faringite leve a hipóxia devido à obstrução das vias aéreas por uma pseudomembrana. O envolvimento dos linfonodos cervicais pode causar inchaço grave do pescoço (difteria pescoço de touro), e o paciente pode desenvolver febre (≥ 39°C). As lesões cutâneas na difteria cutânea são geralmente cobertas por uma pseudomembrana cinza-amarronzada. Complicações sistêmicas com risco de morte, principalmente perda da função motora (p. ex., dificuldade para engolir) e insuficiência cardíaca congestiva, podem se desenvolver como resultado da ação da toxina diftérica nos neurônios motores periféricos e no miocárdio.
Controlar
O controle da difteria depende da imunização adequada com toxoide diftérico: toxina diftérica inativada por formaldeído, que permanece antigenicamente intacta. O toxoide é preparado pela incubação da toxina diftérica com formaldeído a 37 °C em condições alcalinas. A imunização contra difteria deve começar no segundo mês de vida com uma série de três doses primárias em intervalos de 4 a 8 semanas, seguidas por uma quarta dose aproximadamente 1 ano após a última primária. O toxoide diftérico é amplamente utilizado como um componente da vacina contra difteria-coqueluche-tétano (DPT). Estudos epidemiológicos demonstraram que a imunização contra a difteria é aproximadamente 97% eficaz. Embora a imunização em massa contra a difteria seja praticada nos Estados Unidos e na Europa e as taxas de imunização infantil sejam adequadas, uma grande proporção da população adulta pode ter títulos de anticorpos abaixo dos níveis protetores. Adultos devem ser revacinados com toxoide diftérico a cada 10 anos. De fato, uma imunização de reforço com toxoide diftérico-tetânico deve ser administrada a viajantes com destino a áreas com altas taxas de difteria endêmica (América Central e do Sul, África, Ásia, Rússia e Europa Oriental). Nos últimos anos, o uso de preparações de toxoide altamente purificadas para imunização minimizou reações de hipersensibilidade graves ocasionais. Uma imunização de reforço com toxoide diftérico-tetânico deve ser administrada a viajantes com destino a áreas com altas taxas de difteria endêmica (América Central e do Sul, África, Ásia, Rússia e Europa Oriental). Nos últimos anos, o uso de preparações de toxoide altamente purificadas para imunização minimizou reações de hipersensibilidade graves ocasionais. A imunização de reforço com toxoide diftérico-tetânico deve ser administrada a viajantes com destino a áreas com altas taxas de difteria endêmica (América Central e do Sul, África, Ásia, Rússia e Europa Oriental). Nos últimos anos, o uso de preparações de toxoides altamente purificados para imunização minimizou reações ocasionais de hipersensibilidade grave.
Embora antibióticos (como penicilina e eritromicina) sejam usados como parte do tratamento de pacientes com difteria, a imunização passiva rápida com antitoxina diftérica é mais eficaz na redução da letalidade. A longa meia-vida da antitoxina específica na corrente sanguínea é um fator importante para garantir a neutralização eficaz da toxina diftérica; no entanto, para ser eficaz, a antitoxina deve reagir com a toxina antes de entrar na célula.
Reengenharia da toxina diftérica para o desenvolvimento de citotoxinas específicas do receptor eucariótico
A engenharia de proteínas é um campo novo e em rápido desenvolvimento na biologia molecular; ela combina metodologias de DNA recombinante e síntese de DNA em fase sólida para projetar e construir genes quiméricos cujos produtos têm propriedades únicas. Estudos das relações estrutura-função da toxina diftérica demonstraram claramente que esta toxina é uma proteína de três domínios: catalítico, transmembrana e receptor. Foi possível substituir geneticamente o domínio nativo de ligação ao receptor da toxina diftérica por vários hormônios polipeptídicos e citocinas (por exemplo, hormônio estimulante dos melanócitos α [α-MSH], interleucina (IL) 2, IL-4, IL-6, IL-7, fator de crescimento epidérmico). As proteínas quiméricas ou toxinas de fusão resultantes combinam a especificidade de ligação ao receptor da citocina com os domínios transmembrana e catalítico da toxina. Em cada caso, as toxinas de fusão demonstraram envenenar seletivamente apenas as células que possuem o receptor-alvo correspondente. A primeira dessas toxinas de fusão geneticamente modificadas, DAB 389IL-2, está atualmente sendo avaliada em ensaios clínicos em humanos para o tratamento de linfomas refratários e doenças autoimunes nas quais células com receptores de IL-2 de alta afinidade desempenham um papel importante na patogênese. [ 7 ] A administração de DAB 389 IL-2 demonstrou ser segura, bem tolerada e capaz de induzir remissão duradoura da doença sem efeitos colaterais graves. É provável que as toxinas de fusão baseadas na toxina diftérica se tornem novos agentes biológicos importantes para o tratamento de tumores ou doenças específicas nas quais receptores específicos da superfície celular podem ser alvos.


 [
[