Médico especialista do artigo
Novas publicações
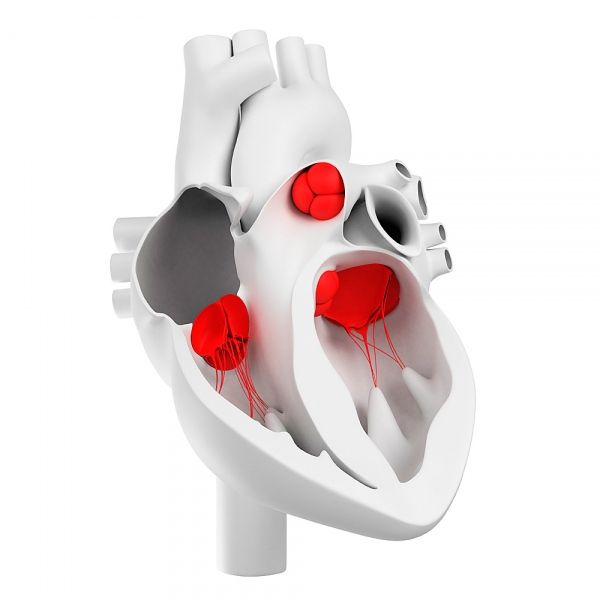
Válvulas cardíacas
Última revisão: 04.07.2025

Todo o conteúdo do iLive é medicamente revisado ou verificado pelos fatos para garantir o máximo de precisão factual possível.
Temos diretrizes rigorosas de fornecimento e vinculamos apenas sites de mídia respeitáveis, instituições de pesquisa acadêmica e, sempre que possível, estudos médicos revisados por pares. Observe que os números entre parênteses ([1], [2], etc.) são links clicáveis para esses estudos.
Se você achar que algum dos nossos conteúdos é impreciso, desatualizado ou questionável, selecione-o e pressione Ctrl + Enter.
Anteriormente, acreditava-se que todas as válvulas cardíacas eram estruturas simples, cuja contribuição para o fluxo sanguíneo unidirecional era simplesmente o movimento passivo em resposta a um gradiente de pressão aplicado. Essa compreensão de "estruturas passivas" levou ao desenvolvimento de substitutos valvares mecânicos e biológicos "passivos".
Está se tornando cada vez mais evidente que as válvulas cardíacas têm estrutura e função mais complexas. Portanto, a criação de um substituto "ativo" para uma válvula cardíaca pressupõe uma semelhança significativa em estrutura e função com a válvula cardíaca natural, o que, no futuro, é bastante realista graças ao desenvolvimento da engenharia de tecidos.
As válvulas cardíacas se desenvolvem a partir de rudimentos embrionários de tecido mesenquimal durante a formação do endocárdio. Durante a morfogênese, formam-se o canal atrioventricular (válvulas cardíacas tricúspide e mitral) e a via de saída ventricular (válvulas cardíacas aórtica e pulmonar).
Como as válvulas cardíacas são organizadas?
O estudo do suprimento sanguíneo para as válvulas foi iniciado por N. Luschka (1852), que injetou uma massa de contraste nos vasos cardíacos. Ele descobriu numerosos vasos sanguíneos nas cúspides das válvulas atrioventriculares e semilunares da aorta e da artéria pulmonar. Ao mesmo tempo, vários manuais sobre anatomia patológica e histologia continham indicações de que as válvulas cardíacas humanas inalteradas não contêm vasos sanguíneos, e estes últimos aparecem nas válvulas apenas em vários processos patológicos - aterosclerose e endocardite de várias etiologias. As informações sobre a ausência de vasos sanguíneos basearam-se principalmente em estudos histológicos. Supôs-se que, na ausência de vasos sanguíneos na parte livre das cúspides, sua nutrição ocorre pela filtragem do fluido do plasma sanguíneo que lava as cúspides. Foi observada a penetração de alguns vasos, juntamente com fibras de tecido muscular estriado, nas bases das válvulas e cordas tendíneas.
Entretanto, ao injetar vasos cardíacos com vários corantes (tinta da Índia em gelatina, bismuto em gelatina, suspensão aquosa de tinta da Índia preta, soluções de carmim ou azul de tripano), verificou-se que os vasos penetram nas válvulas cardíacas atrioventriculares, nas válvulas aórticas e na artéria pulmonar, juntamente com o tecido muscular cardíaco, ligeiramente antes de atingir a borda livre da válvula.
No tecido conjuntivo fibroso frouxo das cúspides da válvula atrioventricular, foram encontrados vasos principais individuais que se anastomosavam com vasos em áreas adjacentes do tecido muscular estriado cardíaco.
O maior número de vasos sanguíneos estava localizado na base e um número comparativamente menor na parte livre dessas válvulas.
De acordo com K. I. Kulchitsky et al. (1990), um diâmetro maior de vasos arteriais e venosos é encontrado na válvula mitral. Na base das cúspides desta válvula estão localizados principalmente os vasos principais com uma rede de capilares em alça estreita, penetrando na parte basal da cúspide e ocupando 10% de sua área. Na válvula tricúspide, os vasos arteriais têm um diâmetro menor do que na válvula mitral. Nas cúspides desta válvula, existem principalmente vasos dispersos e alças comparativamente largas de capilares sanguíneos. Na válvula mitral, a cúspide anterior é suprida com sangue mais intensamente, na válvula tricúspide - as cúspides anterior e posterior, que desempenham a principal função de fechamento. A proporção dos diâmetros dos vasos arteriais e venosos nas válvulas atrioventriculares do coração de pessoas maduras é de 1:1,5. As alças capilares são poligonais e estão localizadas perpendicularmente à base das cúspides da válvula. Os vasos formam uma rede plana localizada sob o endotélio no lado atrial. Vasos sanguíneos também são encontrados nas cordas tendíneas, onde penetram a partir dos músculos papilares dos ventrículos direito e esquerdo a uma distância de até 30% do comprimento das cordas tendíneas. Numerosos vasos sanguíneos formam alças arqueadas na base das cordas tendíneas. As válvulas cardíacas da aorta e do tronco pulmonar diferem significativamente das válvulas atrioventriculares em termos de suprimento sanguíneo. Os vasos principais de diâmetro relativamente menor aproximam-se da base das cúspides semilunares das válvulas da aorta e do tronco pulmonar. Os ramos curtos desses vasos terminam em alças capilares de formato oval e poligonal irregular. Eles estão localizados principalmente perto da base das cúspides semilunares. Os vasos venosos na base das válvulas aórtica e pulmonar também têm um diâmetro menor do que aqueles na base das válvulas atrioventriculares. A proporção dos diâmetros dos vasos arteriais e venosos nas válvulas aórtica e pulmonar do coração de pessoas maduras é de 1:1,4. Ramos laterais curtos se estendem dos vasos maiores, terminando em alças de capilares de formas ovais e poligonais irregulares.

Com a idade, ocorre um espessamento das fibras do tecido conjuntivo, tanto colágenas quanto elásticas, bem como uma diminuição na quantidade de tecido conjuntivo fibroso frouxo não formado, desenvolvendo-se esclerose do tecido das cúspides da valva atrioventricular e das cúspides semilunares das valvas aórtica e pulmonar. O comprimento das fibras musculares estriadas cardíacas nas valvas diminui e, consequentemente, sua quantidade e o número de vasos sanguíneos que penetram nas valvas cardíacas diminuem. Devido a essas alterações, as valvas cardíacas perdem suas propriedades elásticas e resilientes, o que afeta o mecanismo de fechamento valvar e a hemodinâmica.
As válvulas cardíacas possuem redes de capilares linfáticos e um pequeno número de vasos linfáticos equipados com válvulas. Os capilares linfáticos das cúspides têm uma aparência característica: seu lúmen é muito irregular, o mesmo capilar em diferentes áreas tem um diâmetro diferente. Nos locais onde vários capilares se fundem, formam-se expansões - lacunas de vários formatos. As alças das redes são frequentemente poligonais irregulares, menos frequentemente ovais ou redondas. Frequentemente, as alças das redes linfáticas não são fechadas e os capilares linfáticos terminam cegamente. As alças dos capilares linfáticos são orientadas mais frequentemente na direção da borda livre da cúspide para sua base. Em alguns casos, uma rede de duas camadas de capilares linfáticos foi encontrada nas cúspides da válvula atrioventricular.
Os plexos nervosos endocárdicos estão localizados em suas diversas camadas, principalmente sob o endotélio. Na borda livre das cúspides valvares, as fibras nervosas localizam-se principalmente radialmente, conectando-se às das cordas tendíneas. Mais próximo da base das cúspides, forma-se um plexo nervoso reticular de grande espessura, que se conecta ao plexo localizado ao redor dos anéis fibrosos. Nas cúspides semilunares, a rede nervosa endocárdica é mais esparsa. No local de inserção das válvulas, torna-se densa e multicamadas.
Estrutura celular das válvulas cardíacas
As células intersticiais valvares, responsáveis pela manutenção da estrutura da valva, apresentam formato alongado, com numerosos processos finos que se estendem por toda a matriz valvar. Existem duas populações de células intersticiais valvares que diferem em morfologia e estrutura; uma possui propriedades contráteis e é caracterizada pela presença de fibrilas contráteis, a outra possui propriedades secretoras e possui um retículo endoplasmático e aparelho de Golgi bem desenvolvidos. A função contrátil resiste à pressão hemodinâmica e é ainda sustentada pela produção de proteínas contráteis cardíacas e esqueléticas, que incluem as cadeias pesadas de alfa e beta-miosina e várias isoformas de troponina. A contração do folheto da valva cardíaca foi demonstrada em resposta a vários agentes vasoativos, sugerindo um estímulo biológico coordenado para o funcionamento bem-sucedido da valva.
As células intersticiais também são componentes essenciais do sistema de reparo de estruturas como as válvulas cardíacas. O movimento constante dos folhetos valvares e a deformação do tecido conjuntivo associada produzem danos aos quais as células intersticiais valvares respondem para manter a integridade da válvula. O processo de reparo parece ser vital para o funcionamento normal da válvula, e a ausência dessas células nos modelos atuais de válvulas artificiais é provavelmente um fator que contribui para o dano estrutural das biopróteses.
Uma importante área de pesquisa em células intersticiais é o estudo das interações entre elas e a matriz circundante, mediadas por moléculas de adesão focal. As adesões focais são sítios especializados de interação célula-matriz que ligam o citoesqueleto celular às proteínas da matriz por meio de integrinas. Elas também atuam como sítios de transdução de sinal, transmitindo informações mecânicas da matriz extracelular que podem desencadear respostas que incluem, entre outras, adesão, migração, crescimento e diferenciação celular. Compreender a biologia celular das células intersticiais valvares é vital para elucidar os mecanismos pelos quais essas células interagem entre si e com o ambiente, para que essa função possa ser recapitulada em válvulas artificiais.
Em conexão com o desenvolvimento de uma direção promissora na engenharia de tecidos de válvulas cardíacas, estudos de células intersticiais são realizados utilizando uma ampla gama de técnicas. A presença do citoesqueleto celular é confirmada pela coloração para vimentina, desmina, troponina, alfa-actina e miosina de músculo liso, cadeias pesadas de alfa e beta-miosina, cadeias leves-2 de miosina cardíaca, alfa e beta-tubulina. A contratilidade celular é confirmada por uma resposta positiva à epinefrina, angiotensina II, bradicinina, carbacol, cloreto de potássio e endotélio I. As inter-relações celulares são determinadas por interações de gap funcional e verificadas por microinjeções de carboxifluoresceína. A secreção da matriz é estabelecida pela coloração para prolil-4-hidroxilase/colágeno tipo II, fibronectina, sulfato de condroitina e laminina. A inervação é estabelecida pela proximidade das terminações nervosas motoras, refletida pela atividade do neuropeptídeo Y tirosina hidroxilase, acetilcolinesterase, polipeptídeo intestinal vasoativo, substância P e peptídeo relacionado ao gene da pimenta. Os fatores mitogênicos são estimados pelo fator de crescimento derivado de plaquetas, fator de crescimento básico de fibroblastos e serotonina (5-HT). Os fibroblastos de células intersticiais estudados são caracterizados por membrana basal incompleta, prolongamentos citoplasmáticos longos e finos, estreita conexão com a matriz, retículo endoplasmático e aparelho de Golgi bem desenvolvidos e irregulares, riqueza em microfilamentos e formação de ligações adesivas.
As células endocárdicas valvares formam uma bainha atrombogênica funcional ao redor de cada válvula cardíaca, semelhante ao endotélio vascular. O método amplamente utilizado de substituição valvar elimina a função protetora do endocárdio, o que pode levar à deposição de plaquetas e fibrina em válvulas artificiais, ao desenvolvimento de infecção bacteriana e à calcificação tecidual. Outra provável função dessas células é a regulação das células intersticiais valvares subjacentes, semelhante à regulação das células musculares lisas pelo endotélio. Existem interações complexas entre o endotélio e as células adjacentes, mediadas em parte por fatores solúveis secretados pelas células endoteliais. Essas células formam uma enorme superfície coberta por microprotrusões no lado luminal, aumentando assim a exposição e a possível interação com substâncias metabólicas no sangue circulante.
O endotélio frequentemente apresenta diferenças morfológicas e funcionais causadas por tensões de cisalhamento na parede vascular devido ao fluxo sanguíneo, e isso também se aplica às células endocárdicas valvares, que adotam uma forma alongada ou poligonal. Alterações na estrutura celular podem ocorrer devido à ação da hemodinâmica local em componentes do citoesqueleto celular ou por efeitos secundários causados por alterações na matriz extracelular subjacente. No nível ultraestrutural, as células endocárdicas valvares possuem conexões intercelulares, vesículas plasmáticas, um retículo endoplasmático rugoso e um aparelho de Golgi. Embora produzam o fator de von Willebrand tanto in vivo quanto in vitro, elas não possuem corpúsculos de Weibel-Palade (grânulos específicos contendo o fator de von Willebrand), que são organelas características do endotélio vascular. As células endocárdicas valvares são caracterizadas por junções fortes, interações funcionais de lacunas e dobras marginais sobrepostas.
As células endocárdicas mantêm sua atividade metabólica mesmo in vitro: produzem fator de von Willebrand, prostaciclina, óxido nítrico sintase, demonstram atividade da enzima conversora de angiotensina e secretam intensamente as moléculas de adesão ICAM-1 e ELAM-1, importantes para a ligação de células mononucleares durante o desenvolvimento de uma resposta imune. Todos esses marcadores devem ser considerados no cultivo de uma cultura celular ideal para a criação de uma válvula artificial por engenharia de tecidos, mas o potencial imunoestimulante das próprias células endocárdicas valvares pode limitar seu uso.
A matriz extracelular das válvulas cardíacas consiste em macromoléculas fibrosas de colágeno e elastina, proteoglicanos e glicoproteínas. O colágeno representa 60% do peso seco da válvula, a elastina 10% e os proteoglicanos 20%. O componente colágeno fornece a principal estabilidade mecânica da válvula e é representado pelos colágenos dos tipos I (74%), II (24%) e V (2%). Feixes de fios de colágeno são envolvidos por uma bainha de elastina, que medeia as interações entre eles. As cadeias laterais de glicosaminoglicanos das moléculas de proteoglicanos tendem a formar uma substância gelatinosa na qual outras moléculas da matriz interagem para formar ligações permanentes e outros componentes são depositados. Os glicosaminoglicanos das válvulas cardíacas humanas consistem principalmente de ácido hialurônico, em menor extensão de dermatan sulfato, condroitina-4-sulfato e condroitina-6-sulfato, com uma quantidade mínima de heparan sulfato. A remodelação e a renovação do tecido da matriz são reguladas pelas metaloproteinases da matriz (MMPs) e seus inibidores teciduais (ITs). Essas moléculas também estão envolvidas em uma ampla gama de processos fisiológicos e patológicos. Algumas metaloproteinases, incluindo colagenases intersticiais (MMP-1, MMP-13) e gelatinases (MMP-2, MMP-9) e seus inibidores teciduais (TI-1, TI-2, TI-3), são encontradas em todas as válvulas cardíacas. A produção excessiva de metaloproteinases é característica de condições patológicas da válvula cardíaca.
 [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
[ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
Válvulas cardíacas e sua estrutura morfológica
As válvulas cardíacas consistem em três camadas morfologicamente diferentes e funcionalmente significativas da matriz dos folhetos: fibrosa, esponjosa e ventricular.
A camada fibrosa forma uma estrutura resistente à carga para o folheto valvar, consistindo em camadas de fibras colágenas. Essas fibras são dispostas radialmente em dobras para permitir que as válvulas arteriais se estiquem durante o fechamento. A camada fibrosa situa-se próxima à superfície externa de saída dessas válvulas. A camada fibrosa das válvulas atrioventriculares serve como continuação dos feixes de colágeno das cordas tendíneas. Ela está localizada entre as camadas esponjosa (de entrada) e ventricular (de saída).
Entre as camadas fibrosa e ventricular encontra-se a camada esponjosa (esponjosa). A camada esponjosa consiste em tecido conjuntivo mal organizado em um meio viscoso. Os componentes dominantes da matriz dessa camada são proteoglicanos com colágeno orientado aleatoriamente e finas camadas de elastina. As cadeias laterais das moléculas de proteoglicanos possuem uma forte carga negativa, o que afeta sua alta capacidade de se ligar à água e formar um gel de matriz poroso. A camada esponjosa da matriz reduz o estresse mecânico nos folhetos da válvula cardíaca e mantém sua flexibilidade.
A camada ventricular é muito mais fina que as demais e rica em fibras elásticas, que permitem ao tecido resistir à deformação constante. A elastina possui uma estrutura esponjosa que envolve e conecta as fibras de colágeno, mantendo-as em um estado neutro e dobrado. A camada de entrada da válvula (ventricular - para válvulas arteriais e esponjosa - para atrioventriculares) contém mais elastina do que a de saída, o que proporciona o amolecimento do choque hidráulico quando as cúspides se fecham. Essa relação entre colágeno e elastina permite que as cúspides se estiquem até 40% sem deformação estável. Quando expostas a uma pequena carga, as estruturas de colágeno dessa camada são orientadas na direção da carga, e sua resistência ao crescimento adicional da carga aumenta.
Assim, a ideia das válvulas cardíacas como simples duplicações endocárdicas não é apenas simplificada, mas também essencialmente incorreta. As válvulas cardíacas são órgãos complexos que incluem fibras musculares estriadas, vasos sanguíneos e linfáticos e elementos nervosos. Tanto em sua estrutura quanto em seu funcionamento, as válvulas são parte integrante de todas as estruturas cardíacas. A análise da função valvar normal deve levar em consideração sua organização celular, bem como a interação das células entre si e com a matriz. O conhecimento adquirido com esses estudos está liderando o projeto e o desenvolvimento de próteses valvares utilizando engenharia de tecidos.

