Médico especialista do artigo
Novas publicações
Patogénese da hepatite B
Última revisão: 07.07.2025

Todo o conteúdo do iLive é medicamente revisado ou verificado pelos fatos para garantir o máximo de precisão factual possível.
Temos diretrizes rigorosas de fornecimento e vinculamos apenas sites de mídia respeitáveis, instituições de pesquisa acadêmica e, sempre que possível, estudos médicos revisados por pares. Observe que os números entre parênteses ([1], [2], etc.) são links clicáveis para esses estudos.
Se você achar que algum dos nossos conteúdos é impreciso, desatualizado ou questionável, selecione-o e pressione Ctrl + Enter.
Na patogênese da hepatite B, vários elos principais na cadeia patogênica podem ser identificados:
- introdução do patógeno - infecção;
- fixação no hepatócito e penetração na célula;
- multiplicação do vírus e sua “expulsão” para a superfície do hepatócito, bem como para o sangue;
- ativação de reações imunológicas visando eliminar o patógeno;
- danos do complexo imune a órgãos e sistemas;
- formação de imunidade, liberação do patógeno, recuperação.
Como a infecção pela hepatite B sempre ocorre por via parenteral, pode-se considerar que o momento da infecção é praticamente equivalente à penetração do vírus no sangue. As tentativas de alguns pesquisadores de distinguir as fases enteral e regional na hepatite B são pouco fundamentadas. Há mais motivos para acreditar que o vírus entra imediatamente no fígado com a corrente sanguínea.
O tropismo do vírus da hepatite B para o tecido hepático é predeterminado pela presença de um receptor especial no HBsAg – um polipeptídeo com peso molecular de 31.000 Da (P31), que possui atividade de ligação à albumina. Uma zona de albumina semelhante também é encontrada na membrana dos hepatócitos no fígado de humanos e chimpanzés, o que essencialmente determina o tropismo do HBV para o fígado de humanos e chimpanzés.
Quando o vírus penetra no hepatócito, o DNA viral é liberado, o qual, ao entrar no núcleo do hepatócito e atuar como matriz para a síntese de ácidos nucleicos, desencadeia uma série de reações biológicas sequenciais, cujo resultado é a montagem do nucleocapsídeo do vírus. O nucleocapsídeo migra através da membrana nuclear para o citoplasma, onde ocorre a montagem final das partículas de Dane – o vírus da hepatite B completo.
Deve-se notar, no entanto, que quando um hepatócito é infectado, o processo pode ocorrer de duas maneiras: replicativa e integrativa. No primeiro caso, desenvolve-se um quadro de hepatite aguda ou crônica e, no segundo, a transmissão do vírus.
As razões que determinam os dois tipos de interação entre o DNA viral e os hepatócitos não foram estabelecidas com precisão. Muito provavelmente, o tipo de resposta é determinado geneticamente.
O resultado da interação replicativa é a montagem das estruturas antigênicas centrais (no núcleo) e a montagem do vírus completo (no citoplasma), seguida pela apresentação do vírus completo ou de seus antígenos na membrana ou na estrutura da membrana do hepatócito.
É geralmente aceito que a replicação viral não resulta em dano celular ao nível dos hepatócitos, uma vez que o vírus da hepatite B não possui efeito citopático. Essa posição não pode ser considerada incontestável, pois se baseia em dados experimentais que, embora indiquem a ausência de efeito citopático do vírus da hepatite B, foram obtidos em culturas de tecidos e, portanto, não podem ser totalmente extrapolados para a hepatite B viral em humanos. De qualquer forma, a questão da ausência de dano aos hepatócitos durante a fase replicativa requer estudos adicionais.
No entanto, independentemente da natureza da interação do vírus com a célula, o fígado está necessariamente envolvido no processo imunopatológico. Nesse caso, o dano aos hepatócitos está associado ao fato de que, como resultado da expressão de antígenos virais na membrana do hepatócito e da liberação de antígenos virais na livre circulação, uma cadeia de reações imunológicas celulares e humorais sequenciais é ativada, visando, em última análise, a remoção do vírus do corpo. Esse processo é realizado em total conformidade com os padrões gerais da resposta imune a infecções virais. Para eliminar o patógeno, são incluídas reações citotóxicas celulares, mediadas por várias classes de células efetoras: células K, células T, células natural killer e macrófagos. Durante essas reações, os hepatócitos infectados são destruídos, o que é acompanhado pela liberação de antígenos virais (HBcAg, HBeAg, HBsAg), que desencadeiam o sistema de gênese de anticorpos, resultando no acúmulo de anticorpos específicos no sangue, principalmente para o núcleo - anti-HBc e antígeno-e - anti-HBE. Consequentemente, a liberação da célula hepática do vírus ocorre no processo de sua morte devido às reações de citólise celular.
Ao mesmo tempo, anticorpos específicos que se acumulam no sangue ligam-se aos antígenos virais, formando imunocomplexos fagocitados por macrófagos e excretados pelos rins. Nesse caso, podem ocorrer diversas lesões por imunocomplexos, como glomerulonefrite, arterite, artralgia, erupções cutâneas, etc. Com a participação de anticorpos específicos, o corpo é limpo do patógeno e ocorre a recuperação completa.
De acordo com o conceito delineado da patogênese da hepatite B, toda a diversidade de variantes clínicas do curso da doença é geralmente explicada pelas peculiaridades da interação do vírus e da cooperação de células imunocompetentes, ou seja, pela força da resposta imune à presença de antígenos virais. De acordo com conceitos modernos, a força da resposta imune é geneticamente determinada e ligada aos antígenos de histocompatibilidade do locus HLA de primeira classe.
É geralmente aceito que, em condições de resposta imune adequada aos antígenos virais, a hepatite aguda se desenvolve clinicamente com um curso cíclico e recuperação completa. No contexto de uma diminuição da resposta imune aos antígenos virais, a citólise imunomediada é insignificante, portanto, não há eliminação efetiva das células hepáticas infectadas, o que leva a manifestações clínicas leves com persistência prolongada do vírus e, possivelmente, ao desenvolvimento de hepatite crônica. Ao mesmo tempo, ao contrário, no caso de uma forte resposta imune geneticamente determinada e infecção maciça (hemotransfusão), surgem extensas áreas de dano às células hepáticas, que clinicamente correspondem a formas graves e malignas da doença.
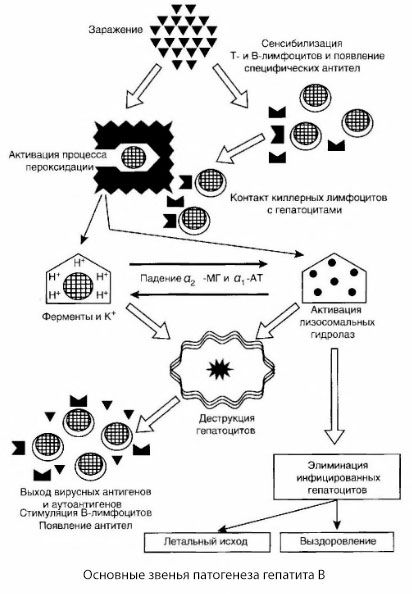
O esquema apresentado da patogênese da hepatite B se distingue por sua coerência; no entanto, contém uma série de pontos controversos e pouco estudados.
Se seguirmos o conceito da hepatite B como uma doença imunopatológica, podemos esperar um aumento nas reações de citotoxicidade celular com o aumento da gravidade da doença. No entanto, em formas graves, os índices da ligação celular da imunidade são drasticamente reduzidos, incluindo uma queda múltipla, em comparação com aqueles em crianças saudáveis, e o índice de citotoxicidade das células K. Na forma maligna, durante o período de desenvolvimento de necrose hepática maciça e especialmente coma hepático, observa-se uma incapacidade completa dos linfócitos de se transformarem em blastos sob a influência de fitohemattlutinina, endotoxina estafilocócica e HBsAg. Além disso, não há capacidade dos leucócitos de migrarem de acordo com a reação de inibição da migração de leucócitos (LMIC), e um aumento acentuado na permeabilidade das membranas dos linfócitos é revelado de acordo com os resultados de seus estudos usando uma sonda fluorescente de tetraciclina.
Assim, se os índices de fluorescência dos linfócitos em pessoas saudáveis são de 9,9 ± 2%, e na hepatite B típica com curso benigno aumentam para 22,3 ± 2,7%, então nas formas malignas o número de linfócitos fluorescentes atinge uma média de 63,5 ± 5,8%. Como o aumento da permeabilidade das membranas celulares é avaliado inequivocamente na literatura como um indicador confiável de sua inferioridade funcional, pode-se concluir que na hepatite B, especialmente na forma maligna, há dano grave aos linfócitos. Isso também é evidenciado pelos índices de citotoxicidade das células K. Na forma grave, na 1ª-2ª semana da doença, a citotoxicidade é de 15,5 ± 8,8%, e na forma maligna, na 1ª semana - 6,0 ± 2,6, na 2ª - 22,0 ± 6,3% com uma norma de 44,8 ± 2,6%.
Os dados apresentados indicam claramente distúrbios pronunciados na ligação celular da imunidade em pacientes com formas graves de hepatite B. Também é óbvio que essas alterações ocorrem secundariamente, como resultado de danos às células imunocompetentes por metabólitos tóxicos e, possivelmente, complexos imunes circulantes.
Como estudos demonstraram, em pacientes com formas graves de hepatite B, especialmente no caso de desenvolvimento de necrose hepática maciça, o título de HBsAg e HBeAg no soro sanguíneo diminui e, ao mesmo tempo, os anticorpos para o antígeno de superfície começam a ser detectados em títulos elevados, o que é completamente atípico para as formas benignas da doença, nas quais os anti-HBV aparecem apenas no 3º ao 5º mês da doença.
O rápido desaparecimento dos antígenos do vírus da hepatite B com o aparecimento simultâneo de altos títulos de anticorpos antivirais sugere a formação intensiva de complexos imunes e sua possível participação na patogênese do desenvolvimento de necrose hepática maciça.
Assim, os materiais factuais não nos permitem interpretar a hepatite B de forma inequívoca apenas do ponto de vista da agressão imunopatológica. E a questão não é apenas que não se encontra relação entre a profundidade e a prevalência das alterações morfológicas no fígado, por um lado, e a gravidade dos fatores de imunidade celular, por outro. Teoricamente, essa circunstância poderia ser explicada pelos estágios tardios do estudo dos indicadores de imunidade celular, quando as células imunocompetentes foram submetidas a poderosos efeitos tóxicos devido à crescente insuficiência funcional do fígado. É claro que se pode presumir que a citólise imune dos hepatócitos ocorre nos estágios iniciais do processo infeccioso, possivelmente até mesmo antes do aparecimento dos sintomas clínicos de lesão hepática grave. Entretanto, tal suposição é improvável, uma vez que indicadores semelhantes de imunidade celular foram detectados em pacientes com o curso mais agudo (relâmpago) da doença e, além disso, durante o exame morfológico do tecido hepático, não foi detectada infiltração linfocítica maciça, enquanto, ao mesmo tempo, campos contínuos de epitélio necrótico foram detectados sem os fenômenos de reabsorção e agressão linfocítica.
É muito difícil explicar o quadro morfológico da hepatite aguda apenas do ponto de vista da citólise celular imune; portanto, em estudos iniciais, o efeito citotóxico do vírus da hepatite B não foi excluído.
Atualmente, essa suposição foi parcialmente confirmada pela descoberta do vírus da hepatite B. Como estudos demonstraram, a frequência de detecção de marcadores da hepatite D depende diretamente da gravidade da doença: nas formas leves, são detectados em 14%, nas moderadas em 18%, nas graves em 30% e nas malignas em 52% dos pacientes. Considerando que o vírus da hepatite D tem um efeito citopático necrosgênico, pode-se considerar estabelecido que a coinfecção pelos vírus da hepatite B e D é de grande importância no desenvolvimento das formas fulminantes da hepatite B.
A patogênese da hepatite B pode ser apresentada da seguinte forma. Após a penetração do vírus da hepatite B nos hepatócitos, um ataque imunológico aos hepatócitos infectados é induzido por células T-killer, que secretam linfotoxinas em direção às células hepáticas.
Os mecanismos subjacentes ao dano hepático na hepatite B ainda não foram estabelecidos. O papel principal é desempenhado pelos processos ativados de peroxidação lipídica e hidrolases lisossomais. O gatilho pode ser a liberação de linfotoxinas pelas células efetoras em contato com os hepatócitos, mas é possível que o próprio vírus seja o iniciador dos processos de peroxidação. Posteriormente, o processo patológico provavelmente se desenvolve na seguinte sequência.
- Interação do fator de agressão (linfotoxinas ou vírus) com macromoléculas biológicas (eventualmente com componentes das membranas do retículo endoplasmático capazes de participar de processos de desintoxicação, por analogia com outros agentes danosos, como foi demonstrado em relação ao tetracloreto de carbono).
- Formação de radicais livres, ativação de processos de peroxidação lipídica e aumento da permeabilidade de todas as membranas hepatocelulares (síndrome de citólise).
- Movimento de substâncias biologicamente ativas ao longo do gradiente de concentração - perda de enzimas de várias localizações intracelulares, doadores de energia, potássio, etc. Acúmulo de sódio e cálcio nas células, mudança de pH em direção à acidose intracelular.
- Ativação e liberação de hidrolases lisossômicas (RNAse, DNAse, catepsinas, etc.) com a quebra das células do fígado e liberação de autoantígenos.
- Estimulação dos sistemas imunológicos T e B com formação de sensibilização específica de linfócitos T à lipoproteína hepática, bem como formação de autoanticorpos humorais anti-hepáticos.
No esquema proposto para a patogênese da hepatite B, o fator desencadeante são os antígenos virais, cuja produção intensiva é observada nos estágios iniciais da doença e durante todo o período agudo, com exceção das formas malignas, nas quais a produção de antígenos virais praticamente cessa no momento do desenvolvimento de necrose hepática maciça, o que predetermina uma rápida diminuição na replicação viral.
Também é óbvio que os antígenos virais ativam os sistemas T e B da imunidade. Durante esse processo, ocorre uma redistribuição característica das subpopulações de linfócitos T, com o objetivo de organizar uma resposta imune adequada, eliminando hepatócitos infectados, neutralizando antígenos virais, promovendo a sanogênese e a recuperação.
Quando células imunocompetentes interagem com antígenos virais nas membranas dos hepatócitos ou durante a reprodução do vírus dentro de um hepatócito, surgem condições para a ativação dos processos de peroxidação lipídica, que, como se sabe, controla a permeabilidade de todas as membranas celulares e subcelulares.
A partir dessa posição, torna-se compreensível a ocorrência da síndrome de citólise, um aumento da permeabilidade das membranas celulares, tão natural e altamente característica da hepatite viral.
O resultado final da síndrome de citólise pode ser o desacoplamento completo da fosforilação oxidativa, vazamento de material celular e morte do parênquima hepático.
No entanto, na grande maioria dos casos, esses processos não se desenvolvem de forma tão fatal. Somente nas formas malignas da doença o processo patológico progride de forma avalanche e irreversível, visto que ocorrem infecção maciça, processo imunológico pronunciado, ativação excessiva dos processos de peroxidação e hidrodases lisossomais e fenômenos de agressão autoimune.
Os mesmos mecanismos são observados no curso favorável da hepatite B, com a única peculiaridade de que todos ocorrem em um nível qualitativamente diferente. Ao contrário dos casos de necrose hepática maciça, no curso favorável da doença, o número de hepatócitos infectados e, portanto, a zona de citólise imunopatológica é menor, os processos de peroxidação lipídica não são tão significativamente intensificados, a ativação de hidrolases ácidas leva apenas a uma autólise limitada com liberação insignificante de autoantígenos e, portanto, sem autoagressão maciça, ou seja, todas as etapas da patogênese no curso favorável são realizadas dentro da estrutura da organização estrutural preservada do parênquima hepático e são restringidas por sistemas de defesa (antioxidantes, inibidores, etc.) e, portanto, não têm um efeito tão destrutivo.
As causas dos sintomas de intoxicação na hepatite viral não foram totalmente estudadas. A proposta de distinguir entre a chamada intoxicação primária, ou viral, e a secundária (troca ou metabólica) pode ser considerada positiva, embora isso não revele o mecanismo íntimo da ocorrência da síndrome tóxica geral. Em primeiro lugar, os vírus da hepatite não têm propriedades tóxicas e, em segundo lugar, a concentração de muitos metabólitos nem sempre se correlaciona com a gravidade da doença e o grau de expressão dos sintomas de toxicose. Sabe-se também que a concentração de antígenos virais não se correlaciona estritamente com a gravidade da intoxicação. Pelo contrário, com o aumento da gravidade da doença e, portanto, com o aumento do grau de toxicose, a concentração de HBsAg diminui e é mais baixa nas formas malignas no momento do início do coma hepático profundo. Ao mesmo tempo, a frequência de detecção e os títulos de anticorpos antivirais específicos dependem diretamente da gravidade da doença.
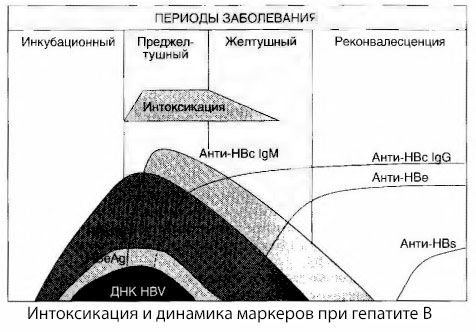
A intoxicação não aparece no momento do registro dos antígenos virais, mas durante o período de circulação no sangue de anticorpos antivirais da classe IgM para o antígeno bovino e o antígeno do sistema E. Além disso, em formas graves e especialmente malignas, uma proporção significativa de pacientes apresenta até mesmo anti-HBs no sangue, o que geralmente nunca é observado em formas leves e moderadas da doença.
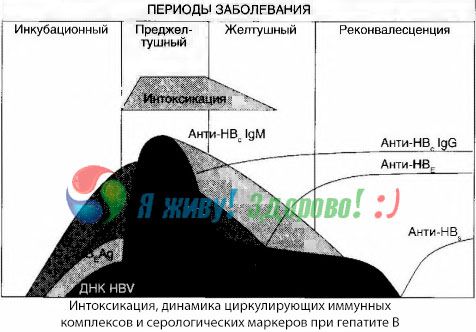
Os dados apresentados permitem concluir que a síndrome toxicológica na hepatite viral, e na hepatite B em particular, não surge como resultado do aparecimento de antígenos virais no sangue, mas sim como consequência da interação de antígenos virais com anticorpos antivirais da classe IgM. O resultado dessa interação, como se sabe, é a formação de imunocomplexos e, possivelmente, de substâncias tóxicas ativas.
Os sintomas de intoxicação surgem no momento do aparecimento de complexos imunes em livre circulação, mas posteriormente tal correlação não é observada.
Uma explicação parcial para isso pode ser encontrada no estudo da composição dos imunocomplexos. Em pacientes com formas graves, circulam no sangue predominantemente complexos de tamanho médio, e em sua composição, no auge da síndrome tóxica, predominam os anticorpos da classe IgG, enquanto durante o período de declínio das manifestações clínicas e convalescença, os complexos tornam-se maiores, e em sua composição, os anticorpos da classe IgG começam a predominar.
Os dados apresentados dizem respeito aos mecanismos de desenvolvimento da síndrome tóxica no período inicial da doença, mas na toxicose que ocorre no auge das manifestações clínicas, eles têm apenas significado parcial, especialmente no desenvolvimento do coma hepático.
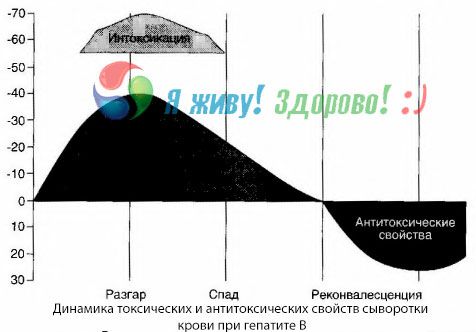
O método de hemoculturas demonstrou que, na hepatite B, as toxinas se acumulam constantemente no sangue, liberadas do tecido hepático danificado e em decomposição. A concentração dessas toxinas é proporcional à gravidade da doença e são de natureza proteica.
Durante o período de recuperação, anticorpos para essa toxina aparecem no sangue; mas no caso de coma hepático, a concentração da toxina no sangue aumenta acentuadamente e os anticorpos não são detectados no sangue.
Patomorfologia da hepatite B
Com base na natureza das alterações morfológicas, distinguem-se três formas de hepatite B aguda:
- forma cíclica,
- necrose hepática maciça;
- hepatite pericolangiolítica colestática.
Na forma cíclica da hepatite B, as alterações distróficas, inflamatórias e proliferativas são mais pronunciadas no centro dos lóbulos, enquanto na hepatite A elas se localizam ao longo da periferia do lóbulo, disseminando-se para o centro. Essas diferenças são explicadas pelas diferentes vias de penetração do vírus no parênquima hepático. O vírus da hepatite A entra no fígado pela veia porta e se espalha para o centro dos lóbulos, enquanto o vírus da hepatite B penetra pela artéria hepática e pelos ramos capilares que irrigam uniformemente todos os lóbulos, até o centro.
O grau de dano ao parênquima hepático, na maioria dos casos, corresponde à gravidade das manifestações clínicas da doença. Nas formas leves, geralmente observa-se necrose focal dos hepatócitos, e nas formas moderadas e graves, necrose zonal (com tendência a se fundir e formar necrose em ponte nas formas graves da doença).
As maiores alterações morfológicas no parênquima são observadas no auge das manifestações clínicas, o que geralmente coincide com a primeira década da doença. Durante a segunda e, especialmente, a terceira década, os processos de regeneração se intensificam. Nesse período, as alterações necrobióticas desaparecem quase completamente e os processos de infiltração celular começam a predominar, com lenta restauração subsequente da estrutura das placas hepatocelulares. No entanto, a restauração completa da estrutura e da função do parênquima hepático ocorre apenas 3 a 6 meses após o início da doença e não em todos os pacientes.
A natureza generalizada da infecção pela hepatite B é confirmada pela detecção de HBsAg não apenas nos hepatócitos, mas também nos rins, pulmões, baço, pâncreas, células da medula óssea, etc.
A hepatite colestática (pericolangiolítica) é uma forma especial da doença, na qual as maiores alterações morfológicas são encontradas nos ductos biliares intra-hepáticos, com um quadro de colangiolite e pericolangiolite. Na forma colestática, a colestase ocorre com dilatação dos capilares biliares com estase de bile neles, com proliferação de colangíolos e infiltrados celulares ao redor deles. As células hepáticas são afetadas de forma insignificante nesta forma de hepatite. Clinicamente, a doença é caracterizada por um curso prolongado com icterícia prolongada. Foi demonstrado que a causa de um curso tão peculiar da doença é o efeito predominante do vírus nas paredes do colangíolo, com um efeito insignificante nos hepatócitos.

