Médico especialista do artigo
Novas publicações
Malformação arteriovenosa
Última revisão: 04.07.2025

Todo o conteúdo do iLive é medicamente revisado ou verificado pelos fatos para garantir o máximo de precisão factual possível.
Temos diretrizes rigorosas de fornecimento e vinculamos apenas sites de mídia respeitáveis, instituições de pesquisa acadêmica e, sempre que possível, estudos médicos revisados por pares. Observe que os números entre parênteses ([1], [2], etc.) são links clicáveis para esses estudos.
Se você achar que algum dos nossos conteúdos é impreciso, desatualizado ou questionável, selecione-o e pressione Ctrl + Enter.
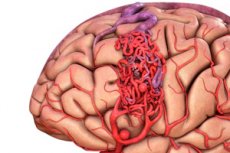
Malformação arteriovenosa é um defeito congênito no desenvolvimento dos vasos sanguíneos, caracterizado pela presença de uma rede anormal de anastomoses arteriovenosas. Na maioria das vezes, as malformações arteriovenosas localizam-se na fossa craniana posterior e apresentam uma estrutura bastante típica – uma ou duas artérias verdadeiras, um emaranhado de MAVs e uma veia de drenagem.
 [ 1 ]
[ 1 ]
Causas malformação arteriovenosa
As causas que podem estar subjacentes ao desenvolvimento da MAV não são totalmente compreendidas, mas acredita-se que possam estar relacionadas a fatores genéticos e ambientais. Aqui estão algumas das possíveis causas que podem estar associadas ao desenvolvimento da MAV:
- Fatores genéticos: Estudos demonstraram que alguns pacientes com MAVs têm histórico familiar da doença. Mutações genéticas podem desempenhar um papel na formação da anormalidade vascular.
- Defeitos congênitos: Anomalias vasculares congênitas podem se desenvolver durante o desenvolvimento embrionário. Podem ser causadas por erros no desenvolvimento dos tecidos vasculares do cérebro.
- Fatores ambientais: Alguns estudos demonstraram uma ligação entre MAVs e certos fatores ambientais, como radiação ou exposição a substâncias tóxicas durante a gravidez. No entanto, essas ligações nem sempre são confirmadas e não explicam todos os casos de MAVs.
- Fatores regionais: Em alguns casos, a MAV pode estar associada a certas áreas geográficas ou grupos étnicos, mas essas associações requerem mais estudos.
Além desses fatores que podem influenciar o desenvolvimento da MAV, é importante observar que esta é uma condição congênita e geralmente é detectada ao nascimento ou na primeira infância, embora os sintomas possam aparecer mais tarde na vida. Mais pesquisas são necessárias para compreender com precisão as causas e os mecanismos do desenvolvimento da MAV.
Patogênese
A mais perigosa é a ruptura das paredes da malformação, acompanhada de hemorragia intracraniana espontânea. Isso ocorre porque o sangue misto circula nos vasos da malformação sob pressão próxima à arterial. E, naturalmente, a alta pressão leva ao estiramento dos vasos degenerativamente alterados, ao aumento de seu volume e ao afinamento da parede. Em última análise, ocorre uma ruptura no local mais fino. Segundo dados estatísticos, isso ocorre em 42% a 60% dos pacientes com MAV. A mortalidade na primeira ruptura da MAV atinge 12% a 15%. Nos demais, o sangramento pode se repetir sem qualquer periodicidade. Observamos um paciente que apresentou onze hemorragias intracranianas espontâneas ao longo de 8 anos. Esse curso relativamente "benigno" da ruptura da MAV, em comparação com a ruptura de aneurismas arteriais, é explicado pelas peculiaridades dos distúrbios hemodinâmicos que ocorrem após a ruptura. Sabe-se que a ruptura de um aneurisma arterial leva na maioria das vezes à hemorragia subaracnóidea (HSA) e ao desenvolvimento de angioespasmo, que nos primeiros minutos tem caráter protetor, ajudando a estancar rapidamente o sangramento, mas posteriormente representa um grande perigo para a vida do paciente.
É o angioespasmo que leva à isquemia e ao edema cerebrais que determina a gravidade da condição do paciente e o prognóstico. Em contraste, o angioespasmo das artérias aferentes da MAV, ao contrário, melhora o suprimento sanguíneo para o cérebro devido à diminuição da descarga arteriovenosa. Quando uma MAV se rompe, hematomas intracerebrais e subdurais são mais frequentemente formados. A passagem de sangue para as cisternas subaracnóideas é secundária. O sangramento da parede rompida da MAV cessa mais rapidamente, uma vez que a pressão sanguínea nela é menor do que nas artérias principais e a parede é mais suscetível à compressão pelo sangue derramado. Naturalmente, isso nem sempre termina bem para o paciente. As rupturas de MAV mais perigosas ocorrem perto dos ventrículos do cérebro, nos gânglios subcorticais e no tronco encefálico. O angioespasmo das artérias aferentes nessa situação ajuda a estancar o sangramento.
O fator determinante na patogênese da ruptura da MAV é o volume de sangue derramado e a localização do hematoma. Os hematomas intracerebrais hemisféricos, mesmo com um volume de até 60 cm³ , evoluem relativamente bem. Eles podem causar distúrbios neurológicos focais graves, mas raramente levam a distúrbios vitais graves. A ruptura do hematoma nos ventrículos do cérebro piora significativamente o prognóstico. Por um lado, o sangue, irritando o epêndima dos ventrículos, aumenta a produção de líquido cefalorraquidiano; por outro lado, afetando o fundo do ventrículo, leva a distúrbios graves das funções dos centros vitais localizados no hipotálamo. A disseminação do sangue por todo o sistema ventricular leva ao tamponamento deste último, o que por si só é incompatível com a vida.
O sangue que penetra nas cisternas subaracnóideas também interrompe a circulação do líquido cefalorraquidiano, dificultando o acesso do líquido cefalorraquidiano às granulações do pachion bloqueadas pelo sangue. Como resultado, a reabsorção do líquido cefalorraquidiano diminui e pode ocorrer hipertensão liquórica aguda, seguida de hidrocefalia interna e externa. Como resultado da degradação dos elementos figurados do sangue derramado, forma-se um grande número de substâncias tóxicas, a maioria das quais com efeito vasoativo. Por um lado, isso leva à vasoconstrição das pequenas artérias piais e, por outro, aumenta a permeabilidade capilar. Os produtos da degradação do sangue também afetam as células nervosas, alterando seus processos bioquímicos e interrompendo a permeabilidade das membranas celulares. Primeiramente, a função da bomba de potássio-sódio muda e o potássio começa a deixar a célula, e o cátion sódio, que é quatro vezes mais hidrofílico que o potássio, corre para tomar seu lugar.
Isso leva primeiro ao edema intracelular na área ao redor da hemorragia e, em seguida, ao inchaço das células. A hipóxia também contribui para o desenvolvimento do edema, que inevitavelmente se soma à compressão dos vasos cerebrais pelo hematoma e ao aumento da pressão do líquido cefalorraquidiano, como já mencionado. A disfunção das partes diencefálicas do cérebro e, acima de tudo, da regulação do equilíbrio hidroeletrolítico leva à retenção de líquidos no corpo e à perda de potássio, o que também aumenta a reação edematosa do cérebro. A patogênese da ruptura da MAV não se limita aos distúrbios cerebrais. Não menos perigosas são as complicações extracerebrais. Em primeiro lugar, trata-se da síndrome cerebrocárdica, que no eletrocardiograma pode simular insuficiência coronariana aguda.
Rapidamente, pacientes com hemorragias intracerebrais desenvolvem pneumonia e insuficiência respiratória. Além disso, a flora bacteriana desempenha um papel secundário. O efeito primário é a influência central nos pulmões, consistindo em broncoespasmo generalizado, aumento da produção de escarro e muco, isquemia do parênquima pulmonar devido ao espasmo generalizado das pequenas artérias pulmonares, o que rapidamente leva a distúrbios distróficos, descamação do epitélio alveolar e diminuição da função de troca gasosa dos pulmões.
Se isso for acompanhado de supressão do reflexo da tosse, insuficiência respiratória do tipo bulbar, surge uma séria ameaça à vida do paciente. Na maioria dos casos, a traquiobronquite purulenta subsequente é pouco responsiva à antibioticoterapia e agrava a insuficiência respiratória, o que afeta imediatamente o aumento da hipóxia cerebral. Assim, a violação da respiração externa, mesmo com compensação relativa dos distúrbios cerebrais, pode levar à morte. Frequentemente, os pacientes recuperam a consciência após o coma, mas morrem devido à insuficiência respiratória progressiva e ao edema cerebral hipóxico.
Alterações distróficas se desenvolvem rapidamente não apenas nos pulmões, mas também no fígado, trato gastrointestinal, glândulas suprarrenais e rins. Infecções do trato urinário e escaras, que se desenvolvem rapidamente na ausência de bons cuidados ao paciente, representam uma ameaça à vida do paciente. Mas essas complicações podem ser evitadas se os médicos se lembrarem delas e souberem como combatê-las.
Resumindo a análise da patogênese da ruptura de MAV, deve-se enfatizar que a mortalidade nessas hemorragias intracranianas é menor do que na ruptura de aneurismas arteriais e acidentes vasculares cerebrais hemorrágicos hipertensivos, embora atinja 12-15%. As MAVs são caracterizadas por hemorragias repetidas, às vezes múltiplas, com periodicidade variável, o que é impossível de prever. Em caso de evolução desfavorável do período pós-hemorrágico, os mecanismos patogênicos listados podem levar à morte.
Sintomas malformação arteriovenosa
Tipo hemorrágico da doença (50-70% dos casos). Este tipo é caracterizado pela presença de hipertensão arterial no paciente, pequeno tamanho do nódulo malformado, sua drenagem para veias profundas e malformação arteriovenosa da fossa craniana posterior, sendo bastante comum.
O tipo hemorrágico é o primeiro sintoma de manifestação de malformação arteriovenosa em 50% dos casos, causando resultados detalhados em 10-15% e incapacidade em 20-30% dos pacientes (N. Martin et al.). O risco anual de hemorragia em pacientes com malformação arteriovenosa é de 1,5-3%. O risco de hemorragia recorrente durante o primeiro ano chega a 8% e aumenta com a idade. O sangramento decorrente de malformação arteriovenosa é a causa de 5-12% de toda a mortalidade materna e 23% de todas as hemorragias intracranianas em gestantes. Quadros de hemorragia subaracnóidea são observados em 52% dos pacientes. Em 17% dos pacientes, ocorrem formas complicadas de hemorragia: formação de hematomas intracerebrais (38%), subdurais (2%) e mistos (13%), e hemotamponamento ventricular se desenvolve em 47%.
O tipo de curso torpe é típico de pacientes com grandes malformações arteriovenosas localizadas no córtex. O suprimento sanguíneo para a malformação arteriovenosa é fornecido por ramos da artéria cerebral média.
Os sintomas mais característicos do curso do tipo torpe são síndrome convulsiva (em 26-27% dos pacientes com malformação arteriovenosa), cefaleias em salvas e déficit neurológico progressivo, como nos tumores cerebrais.
Variantes das manifestações clínicas das malformações arteriovenosas
Como já mencionado, a primeira manifestação clínica mais comum da MAV é a hemorragia intracraniana espontânea (40-60% dos pacientes). Frequentemente, ocorre sem qualquer precursor, em plena saúde. Momentos provocadores podem ser esforço físico, situações estressantes, tensão neuropsíquica, consumo de grandes doses de álcool, etc. No momento da ruptura da MAV, os pacientes sentem uma dor de cabeça súbita e aguda, semelhante a uma pancada ou ruptura. A dor aumenta rapidamente, causando tontura, náusea e vômito.

A perda de consciência pode ocorrer em poucos minutos. Em casos raros, a dor de cabeça pode ser leve, os pacientes não perdem a consciência, mas sentem os membros enfraquecendo e ficando dormentes (geralmente contralateral à hemorragia), e a fala fica prejudicada. Em 15% dos casos, a hemorragia se manifesta como uma crise epiléptica completa, após a qual os pacientes podem permanecer em estado comatoso.
Para determinar a gravidade da hemorragia por MAV, a escala de Hunt-Hess apresentada acima pode ser usada como base, com alguns ajustes. Como as hemorragias por MAV podem apresentar sintomas muito diferentes, os sintomas neurológicos focais podem prevalecer sobre os sintomas cerebrais gerais. Portanto, pacientes com níveis de consciência nos níveis I ou II da escala podem apresentar distúrbios neurológicos focais graves (hemiparesia, hemi-hipestesia, afasia, hemianopsia). Ao contrário das hemorragias aneurismáticas, a ruptura da MAV é determinada não pela gravidade e prevalência do angioespasmo, mas pelo volume e localização do hematoma intracerebral.
A síndrome meníngea se desenvolve após algumas horas e sua gravidade pode variar. A pressão arterial geralmente aumenta, mas não tão acentuadamente e por tanto tempo quanto nos aneurismas arteriais rotos. Geralmente, esse aumento não excede 30-40 mm Hg. No segundo ou terceiro dia, surge a hipertermia de origem central. O quadro dos pacientes piora naturalmente à medida que o edema cerebral aumenta e a decomposição do sangue derramado se intensifica. Isso continua por até 4 a 5 dias. Com um curso favorável, após a estabilização no 6º ao 8º dia, o quadro dos pacientes começa a melhorar. A dinâmica dos sintomas focais depende da localização e do tamanho do hematoma.
Em caso de hemorragia em áreas funcionalmente importantes do cérebro ou destruição de condutores motores, os sintomas de perda aparecem imediatamente e persistem por um longo período sem qualquer dinâmica. Se os sintomas de perda não aparecerem imediatamente, mas aumentarem paralelamente ao edema cerebral, pode-se esperar que o déficit seja restaurado em 2 a 3 semanas, quando o edema regride completamente.
O quadro clínico de uma ruptura de MAV é bastante diverso e depende de muitos fatores, sendo os principais: o volume e a localização da hemorragia, a gravidade da reação edematosa cerebral e o grau de envolvimento das estruturas do tronco encefálico no processo.
Malformações arteriovenosas podem se manifestar como crises epileptiformes (30-40%). A causa de seu desenvolvimento pode ser distúrbios hemocirculatórios em áreas vizinhas do cérebro devido ao fenômeno do roubo. Além disso, a própria malformação pode irritar o córtex cerebral, gerando descargas epilépticas. E já falamos sobre certos tipos de MAV, em torno das quais se desenvolve gliose do tecido cerebral, que também se manifesta frequentemente por crises epilépticas.
Uma síndrome epiléptica causada pela presença de uma MAV é caracterizada por sua ocorrência sem causa na idade adulta, frequentemente na ausência completa de um fator desencadeante. As crises podem ser generalizadas ou focais. A presença de um componente focal claro em uma crise epiléptica na ausência de sintomas cerebrais gerais deve levar à suspeita de uma possível MAV. Mesmo crises generalizadas, se começarem com convulsões principalmente nos mesmos membros, com giro forçado da cabeça e dos olhos para um lado ou outro, são frequentemente uma manifestação de MAV. Menos frequentemente, os pacientes apresentam crises menores, como ausências ou consciência crepuscular. A frequência e a periodicidade das crises epilépticas podem variar: de isoladas a recorrentes.
Formulários
VV Lebedev e coautores identificaram três variantes da síndrome cerebrocárdica com base em dados de ECG:
- Tipo I - violação das funções de automatismo e excitabilidade (taquicardia sinusal ou bradicardia, arritmia, fibrilação atrial);
- Tipo II - alterações nos processos de repolarização, alterações transitórias na fase final do complexo ventricular de acordo com o tipo de isquemia, dano miocárdico com alterações na onda T e na posição do segmento ST;
- Tipo III - distúrbio da função de condução (bloqueio, sinais de aumento da carga no coração direito). Essas alterações no ECG podem ser combinadas e sua gravidade se correlaciona com a gravidade do estado geral dos pacientes.
Complicações e consequências
Uma malformação arteriovenosa (MAV) é uma anomalia vascular congênita na qual artérias e veias estão conectadas sem uma camada capilar interveniente. As complicações e consequências das MAVs podem ser graves e dependem do tamanho, localização e características da malformação específica. Algumas delas incluem:
- Acidente Vascular Cerebral (AVC): Uma das complicações mais graves das MAVs é o risco de AVC. Malformações podem criar vias anormais para o fluxo sanguíneo, o que pode levar a sangramento cerebral, causando um AVC. O AVC pode ter graus variados de gravidade e deixar déficits neurológicos residuais.
- Epilepsia: MAVs podem causar convulsões epilépticas em alguns pacientes, especialmente se a malformação estiver localizada em certas áreas do cérebro.
- Hemorragia: Malformações podem ser imprevisíveis e causar sangramento no cérebro. Isso pode ser uma complicação com risco de vida e levar a consequências graves.
- Hidrocefalia: Se a MAV estiver localizada perto dos ventrículos do cérebro, ela pode causar hidrocefalia, o que pode levar ao acúmulo de líquido extra no cérebro e ao aumento da pressão intracraniana.
- Déficits neurológicos: Uma MAV pode danificar o tecido cerebral circundante e causar uma variedade de déficits neurológicos, incluindo paralisia, distúrbios sensoriais e déficits na fala e na coordenação motora.
- Dor e dores de cabeça: Pacientes com MAV podem sentir dor crônica e dores de cabeça relacionadas à malformação.
- Efeitos psicológicos: Complicações de MAVs podem ter um impacto significativo no bem-estar psicológico dos pacientes, incluindo ansiedade, depressão e estresse.
- Restrições de estilo de vida: Uma vez que uma MAV é detectada, os pacientes podem precisar de mudanças no estilo de vida e recomendações de gerenciamento de risco, incluindo limitação de atividade física e certas atividades.
Diagnósticos malformação arteriovenosa
O diagnóstico de uma malformação arteriovenosa (MAV) geralmente envolve uma variedade de exames de imagem para confirmar a presença e avaliar as características da malformação. Os principais métodos utilizados para diagnosticar uma MAV são:
- Angiografia por ressonância magnética (ARM): A ARM é um dos principais métodos de diagnóstico de MAVs. É um exame não invasivo que visualiza a estrutura dos vasos sanguíneos e o fluxo sanguíneo no cérebro por meio de campos magnéticos e ondas de rádio. A ARM pode determinar a localização, o tamanho e o formato da MAV.
- Angiografia por Subtração Digital (DSA): Este é um procedimento mais invasivo que envolve a injeção de um agente de contraste diretamente nos vasos através de um cateter e o uso de raios X para produzir imagens de alta qualidade dos vasos cerebrais. A DSA permite um exame mais detalhado da estrutura da MAV e dos padrões de fluxo sanguíneo.
- Tomografia computadorizada (TC): A TC pode ser usada para detectar MAVs e avaliar possíveis complicações, como sangramento. Se necessário, um agente de contraste pode ser usado para melhorar a visualização.
- Duplex scanning vascular (ultrassom duplex): Esta técnica pode ser útil para examinar os vasos do pescoço e da cabeça e identificar distúrbios do fluxo sanguíneo associados a MAVs.
- Espectroscopia de ressonância magnética (ERM): A ERM pode fornecer informações sobre a composição química dos tecidos na área da MAV e revelar sinais de alterações metabólicas.
- Ecoencefalografia: É um exame de ultrassom que pode ser usado para avaliar o fluxo sanguíneo e a estrutura do cérebro.
- Angiografia por tomografia computadorizada (ATC): A ATC combina TC e angiografia para produzir imagens tridimensionais dos vasos sanguíneos no cérebro.
Após o diagnóstico de MAV, é importante realizar uma avaliação detalhada das características da malformação, como tamanho, forma e gravidade. Isso ajudará a determinar a necessidade de tratamento e a melhor opção, incluindo remoção cirúrgica, embolização, radioterapia ou observação. A decisão de tratar uma MAV deve ser tomada em colaboração entre o paciente e a equipe de saúde, levando em consideração as circunstâncias individuais de cada caso.
Diagnóstico diferencial
O diagnóstico diferencial de malformações arteriovenosas (MAVs) pode ser um passo importante na avaliação de um paciente com alterações vasculares no cérebro. MAVs são anormalidades vasculares nas quais artérias e veias estão conectadas sem uma camada capilar interveniente. Elas podem causar uma variedade de sintomas e condições, e diferenciá-las de outras doenças vasculares é importante para o tratamento adequado. Algumas condições que podem exigir diagnóstico diferencial com MAVs incluem:
- AVC: AVCs podem mimetizar os sintomas de uma MAV, especialmente se forem causados por alterações vasculares. A distinção pode exigir tomografia computadorizada (TC) ou ressonância magnética (RM) do cérebro para visualizar as alterações vasculares.
- Hematoma: Hematomas, como hematoma subdural ou epidural, podem mimetizar sintomas de MAV, especialmente se acompanhados de cefaleia e sintomas neurológicos. Uma tomografia computadorizada ou ressonância magnética pode ajudar a determinar a causa dos sintomas.
- Tumores cerebrais: Tumores cerebrais podem causar uma variedade de sintomas semelhantes aos de uma MAV. O diagnóstico pode incluir ressonância magnética com contraste e outros exames de imagem.
- Enxaqueca: Enxaquecas com aura podem mimetizar sintomas de MAV, como distúrbios visuais e tontura. O histórico e exames adicionais podem ajudar a diferenciar os dois.
- Vasculite cerebral: A vasculite pode causar inflamação dos vasos sanguíneos e anormalidades vasculares que podem mimetizar os sintomas de uma MAV. Biópsia ou angiografia podem ser utilizadas para diagnosticar a vasculite.
- Trombose venosa: A trombose venosa pode mimetizar os sintomas da MAV, especialmente se houver interrupção do fluxo venoso do cérebro. Exames adicionais podem ajudar a identificar a trombose.
Para um diagnóstico diferencial preciso de MAVs, a investigação inclui um exame clínico abrangente, métodos neuroeducacionais (TC, RNM, angiografia), às vezes biópsia e outros procedimentos especializados, dependendo dos sintomas e circunstâncias específicas.
Quem contactar?
Tratamento malformação arteriovenosa
O tratamento para uma malformação arteriovenosa (MAV) depende do seu tamanho, localização, sintomas e potenciais complicações. Em alguns casos, uma MAV pode ser pequena e assintomática, não exigindo tratamento ativo. No entanto, se houver sintomas ou risco de sangramento, o tratamento pode ser necessário. Alguns dos tratamentos para MAVs incluem:
- Cirurgia: A remoção cirúrgica da MAV pode ser considerada em casos em que a malformação esteja em um local acessível e seja de baixa complexidade. A remoção cirúrgica pode ajudar a prevenir o risco de sangramento e reduzir os sintomas. É um procedimento complexo e pode acarretar riscos, como danos aos tecidos e nervos circundantes.
Intervenções abertas (transcranianas):
- Estágio I - coagulação dos aferentes;
- Estágio II - isolamento do núcleo da malformação arteriovenosa;
- Estágio III - ligadura e coagulação do eferente e remoção da malformação arteriovenosa,
Intervenções endovasculares:
- oclusão estacionária de artérias de alimentação por balão - embolização de fluxo (não controlada);
- combinação de oclusão temporária ou permanente do balão com embolização de fluxo;
- embolização superseletiva.
A malformação arteriovenosa também é tratada com radiocirurgia (Gamma-knife, Cyber-knife, Li nac, etc.).
- Embolização: A embolização é um procedimento que insere materiais médicos ou cola nos vasos sanguíneos para bloquear o fluxo sanguíneo para a MAV. A embolização pode ser usada como etapa preparatória antes da cirurgia ou como tratamento isolado. Pode ajudar a reduzir o sangramento e o tamanho da MAV.
- Radioterapia: A radioterapia pode ser usada para tratar MAVs, especialmente em casos em que outros tratamentos podem ser muito arriscados. A radioterapia visa reduzir o sangramento da MAV e pode exigir várias sessões.
- Medicamentos: Em alguns casos, medicamentos podem ser usados para reduzir sintomas como dor ou cólicas. Medicamentos também podem ser usados para controlar a pressão arterial e reduzir o risco de sangramento.
- Observação e gerenciamento de sintomas: Em algumas situações, especialmente se a MAV for pequena e não causar sintomas, pode-se decidir simplesmente observar a condição e gerenciar os sintomas conforme necessário.
O tratamento para MAVs deve ser individualizado para cada paciente, e a decisão de escolher um método depende das circunstâncias específicas. É importante discutir todas as opções de tratamento com um profissional de saúde e realizar uma avaliação completa do paciente para determinar o melhor plano de tratamento. Os resultados do tratamento podem ser bem-sucedidos e os pacientes podem obter melhora ou recuperação completa, mas cada caso é único.
Previsão
O prognóstico de uma malformação arteriovenosa (MAV) depende de vários fatores, incluindo tamanho, localização, sintomas, idade do paciente e sucesso do tratamento. É importante lembrar que uma MAV é uma condição médica que pode se apresentar de forma diferente em cada paciente, e o prognóstico pode variar de pessoa para pessoa. Aqui estão alguns aspectos gerais do prognóstico de uma MAV:
- Risco de sangramento: O principal risco de uma MAV é o risco de sangramento (hemorragia) no cérebro. MAVs pequenas, com baixo risco de sangramento, podem ter um bom prognóstico e não causar problemas graves. No entanto, MAVs grandes e médias podem representar um risco significativo.
- Sintomas: Os sintomas associados a uma MAV, como dores de cabeça, convulsões, paralisia ou distúrbios sensoriais, podem afetar o prognóstico. Em alguns casos, o tratamento bem-sucedido pode melhorar ou eliminar os sintomas.
- Tamanho e localização: MAVs localizadas em locais mais perigosos, como no cérebro ou perto de estruturas críticas, podem ter um prognóstico pior. No entanto, mesmo muitas MAVs grandes podem ser tratadas com sucesso.
- Tratamento: O tratamento para MAVs pode incluir remoção cirúrgica, embolização, radioterapia ou medicamentos. O tratamento bem-sucedido pode reduzir o risco de sangramento e melhorar o prognóstico.
- Idade: A idade do paciente também pode afetar o prognóstico. Crianças e adultos jovens costumam ter um prognóstico melhor do que pacientes mais velhos.
- Comorbidades: A presença de outras condições médicas ou fatores de risco, como pressão alta ou distúrbios hemorrágicos, pode afetar o prognóstico e o tratamento da MAV.
É importante ressaltar que a MAV requer monitoramento e tratamento médico cuidadosos. A decisão sobre o método de tratamento e o prognóstico deve ser tomada por neurocirurgiões e neurorradiologistas qualificados, com base em uma avaliação completa de cada caso individual.

