Novas publicações
O estudo sublinha a necessidade de terapias específicas para o tipo de células do VIH
Última revisão: 02.07.2025

Todo o conteúdo do iLive é medicamente revisado ou verificado pelos fatos para garantir o máximo de precisão factual possível.
Temos diretrizes rigorosas de fornecimento e vinculamos apenas sites de mídia respeitáveis, instituições de pesquisa acadêmica e, sempre que possível, estudos médicos revisados por pares. Observe que os números entre parênteses ([1], [2], etc.) são links clicáveis para esses estudos.
Se você achar que algum dos nossos conteúdos é impreciso, desatualizado ou questionável, selecione-o e pressione Ctrl + Enter.
Pesquisadores da Universidade de Illinois demonstraram a importância de direcionar tipos celulares específicos no tratamento do HIV. Seu estudo, publicado na revista Proceedings of the National Academy of Sciences, é um dos primeiros a analisar os efeitos diferenciais ou específicos do tipo celular da modulação da latência do HIV nas células mieloides, um tipo de célula imune produzida na medula óssea.
Um dos principais obstáculos para eliminar a infecção pelo HIV é o controle da latência, ou o período durante o qual uma célula infectada permanece dormente e não pode produzir vírus. As células latentes do HIV se acumulam no corpo em locais conhecidos como reservatórios. Reservatórios latentes são problemáticos porque podem começar a produzir vírus a qualquer momento.
A erradicação completa da doença exigiria a remoção de todas as células latentes do corpo ou resistência permanente aos estímulos de ativação. No entanto, a reativação pode ser desencadeada por uma variedade de fatores, incluindo sinais que direcionam a diferenciação das células mieloides.
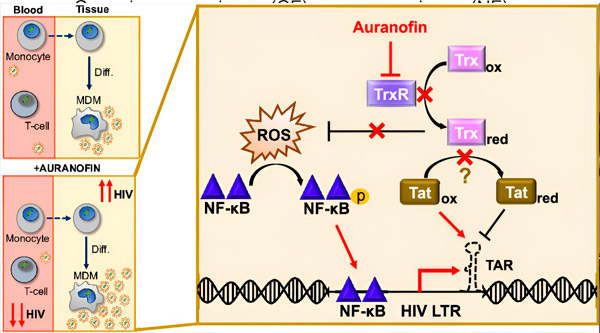
A regulação da latência do HIV em macrófagos derivados de monócitos (MDMs) pode representar um risco para a disseminação viral. A diferenciação de monócitos em macrófagos pode desencadear a reativação do HIV, potencialmente promovendo a disseminação viral nos tecidos (canto superior esquerdo). Um candidato clínico, a Auranofina, reduz o DNA viral no sangue e promove a latência do HIV em células T e monócitos, mas causa reativação do HIV em MDMs (canto inferior esquerdo). Em MDMs, levantamos a hipótese de que a inibição do TrxR pela Auranofina leva ao acúmulo de espécies reativas de oxigênio (ROS), que induzem a ativação do NF-κB e a ativação do promotor LTR do HIV (direita). A inibição do TrxR reduz potencialmente a redução do substrato, permitindo que a proteína Tat permaneça preferencialmente oxidada, onde pode se ligar ao TAR e iniciar a transcrição do HIV. Fonte: Proceedings of the National Academy of Sciences (2024). DOI: 10.1073/pnas.2313823121
Durante anos, a pesquisa sobre a cura do HIV se concentrou em duas abordagens conhecidas como "choque e morte" e "bloqueio e trava". A primeira funciona em combinação com a terapia antirretroviral para ativar células infectadas latentemente e matá-las por apoptose, ou morte celular programada, enquanto a segunda força as células infectadas a um estado latente profundo, do qual não conseguem se reativar por conta própria.
A pesquisa em torno dessas técnicas tradicionalmente se concentra em um tipo de glóbulo branco chamado linfócito T, que é o principal alvo da infecção pelo HIV. No entanto, os reservatórios latentes são compostos por mais do que apenas linfócitos T; na verdade, eles contêm dezenas de tipos celulares diferentes, cada um com seus próprios padrões únicos de expressão genética do HIV.
"Há uma enorme diversidade de células, mesmo dentro de uma única linhagem", disse Collin Kieffer, professor assistente de microbiologia e um dos autores do artigo. "A variabilidade da resposta nesses reservatórios aumenta com cada novo tipo de célula."
Alexandra Blanco, aluna de pós-graduação no laboratório de Kieffer, queria estudar tipos de células que haviam sido ignorados na pesquisa tradicional sobre HIV. Concentrando-se em células mieloides, ela criou uma biblioteca de clones contendo 70 populações de monócitos infectados latentemente. Blanco então analisou as populações clonais e suas respostas à ativação. As respostas variaram amplamente, destacando a grande diversidade dentro de um único tipo de célula.
Essa observação levantou uma nova questão: será que diferentes tipos de células realmente respondem de forma diferente aos tratamentos de latência do HIV? De fato, suas descobertas mostraram que algumas terapias de latência do HIV podem promover a latência em células T e monócitos, enquanto podem reverter a latência em macrófagos.
"Nem todas as células do corpo são iguais", disse Kieffer. "Portanto, faz sentido que nem todas as células infectadas respondam ao vírus da mesma forma."
O artigo destaca a necessidade de que futuros tratamentos para o HIV considerem todos os tipos de células e como cada célula pode responder a possíveis terapias.
Suas descobertas se baseiam na pesquisa de Roy Dar, um ex-professor de bioengenharia de Illinois, cujo laboratório estudou a heterogeneidade na expressão genética do HIV.
"Ele começou, e nós assumimos e construímos até onde estamos hoje", disse Kieffer. "Então, a colaboração realmente impulsionou esses resultados. Isso se transformou em uma nova direção para o nosso laboratório, e estamos muito animados com isso."
Uma descoberta adicional e inesperada da análise de Blanco revelou alterações no tamanho e na forma das células em resposta à infecção, sugerindo que o HIV pode alterar a morfologia celular. O próximo objetivo de Blanco é identificar os mecanismos biológicos subjacentes a essas alterações fenotípicas.
Kieffer e seus colegas de laboratório também estão ansiosos para reproduzir seus resultados, que foram em sua maioria obtidos em uma linhagem celular, em células primárias. Reproduzir os resultados em um modelo mais próximo ao humano aumentaria a relevância clínica do estudo, explicou Kieffer.
"Gostaríamos de realizar triagens maiores em células T, monócitos e macrófagos para identificar possíveis medicamentos que possam atuar em todos esses tipos de células", disse Blanco. "Podemos encontrar ainda mais moléculas que não se comportam de maneira específica para cada tipo de célula."
