Novas publicações
Derivados da talidomida levam à morte de células cancerígenas resistentes
Última revisão: 14.06.2024

Todo o conteúdo do iLive é medicamente revisado ou verificado pelos fatos para garantir o máximo de precisão factual possível.
Temos diretrizes rigorosas de fornecimento e vinculamos apenas sites de mídia respeitáveis, instituições de pesquisa acadêmica e, sempre que possível, estudos médicos revisados por pares. Observe que os números entre parênteses ([1], [2], etc.) são links clicáveis para esses estudos.
Se você achar que algum dos nossos conteúdos é impreciso, desatualizado ou questionável, selecione-o e pressione Ctrl + Enter.
Um estudo realizado pela Goethe-University Frankfurt aponta para a possibilidade de os derivados da talidomida serem potencialmente adequados para o tratamento do cancro. Na década de 1950, a talidomida foi vendida como comprimido para dormir. Mais tarde, tornou-se conhecido por causar graves malformações no feto nos primeiros estágios da gravidez.
A molécula também é conhecida por marcar proteínas na célula para sua destruição. Como parte da pesquisa atual, os cientistas criaram derivados da talidomida. Eles conseguiram mostrar que essas substâncias afetam a destruição de proteínas responsáveis pela sobrevivência das células cancerígenas.
Talvez nenhuma outra molécula tenha um passado tão turbulento como a talidomida. Foi o principal componente de um medicamento aprovado em muitos países na década de 1950 como sedativo-hipnótico. No entanto, logo ficou claro que as mulheres grávidas que tomavam a talidomida frequentemente davam à luz crianças com deformidades graves.
No entanto, nas últimas décadas, a medicina voltou a depositar grandes esperanças nisso. A investigação demonstrou, entre outras coisas, que inibe o crescimento dos vasos sanguíneos e, portanto, é potencialmente adequado para eliminar tumores do seu meio nutriente. Depois também se mostrou muito eficaz no tratamento do mieloma múltiplo, tumores malignos na medula óssea.
“Agora sabemos que a talidomida pode ser chamada de 'cola molecular'”, explica o Dr. Xinglai Cheng, do Instituto de Química Farmacêutica da Universidade Goethe de Frankfurt. "Isso significa que ele é capaz de pegar duas proteínas e juntá-las."
Isso é especialmente interessante porque uma dessas proteínas é uma espécie de “máquina de rotulagem”: ela atribui um rótulo inequívoco “TRASH” a outra proteína.
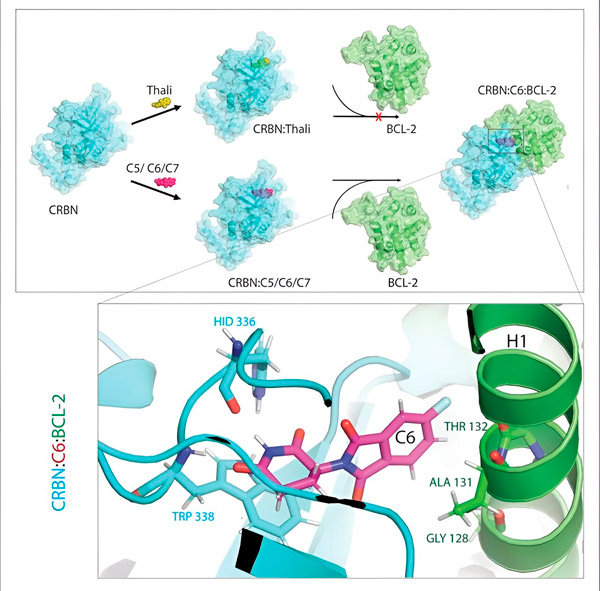
Os derivados da talidomida C5, C6 e C7 modificam o CRBN, a "máquina de rotulagem", para que possa se ligar ao BCL-2. Assim, a molécula BCL-2 está marcada para degradação – uma possível nova estratégia para combater o cancro. Autor: Dr. Xinglai Cheng
O sistema de eliminação de resíduos da célula reconhece esta etiqueta: agarra a molécula de proteína marcada e fragmenta-a. “É este mecanismo que explica os diferentes efeitos da talidomida”, diz Cheng. "Dependendo da proteína marcada, isso pode levar a deformidades durante o desenvolvimento embrionário ou à destruição de células malignas."
Este mecanismo oferece uma grande promessa médica porque as células cancerígenas dependem de certas proteínas para sobreviver. Se pudessem ser sistematicamente visados e destruídos, a doença poderia ser curada. O problema é que a cola molecular é bastante peculiar.
Um de seus parceiros de ligação é sempre uma máquina de marcação celular, ou no jargão científico, uma ligase E3 chamada CRBN. Apenas algumas das muitas milhares de proteínas no corpo podem ser um segundo parceiro - que dependem da cola.
"Então criamos uma série de derivados da talidomida", diz Cheng. “Investigamos então se eles tinham propriedades adesivas e, em caso afirmativo, contra quais proteínas eram eficazes”. Para fazer isso, os pesquisadores adicionaram seus derivados a todas as proteínas da linha celular cultivada. Eles então observaram quais dessas proteínas se degradavam na presença de CRBN.
"No processo, identificamos três derivados que poderiam marcar uma proteína celular que é muito importante para a degradação, a BCL-2", explica Cheng. "O BCL-2 impede que as células ativem seu programa de autodestruição, então, se estiver faltando, as células morrem."
O BCL-2 tem sido, portanto, há muito tempo o foco da pesquisa sobre o câncer. Já existe um medicamento para a leucemia chamado venetoclax, que reduz a eficácia do BCL-2 e, portanto, faz com que as células mutantes se autodestruam.
"No entanto, em muitas células cancerosas, o próprio BCL-2 sofre mutação. Como resultado, venetoclax não inibe mais a proteína", diz Cheng. "Conseguimos mostrar que nossos derivados também marcam essa forma mutada para degradação. Além disso, nossos parceiros do Instituto Max Planck de Biofísica simularam a interação dos derivados da talidomida com BCL-2 no computador. Isso mostrou que os derivados se ligam a sites completamente diferentes do venetoclax - um resultado que mais tarde também pudemos confirmar experimentalmente."
Além disso, os pesquisadores testaram suas substâncias em moscas da fruta com células cancerígenas. A taxa de sobrevivência das moscas tratadas desta forma foi significativamente maior. No entanto, Cheng adverte contra ficar muito entusiasmado porque esses resultados ainda são pesquisas básicas. "Embora mostrem que as moléculas modificadas da talidomida têm um grande potencial terapêutico, ainda não podemos dizer se elas serão comprovadas na prática a qualquer momento."
Os resultados do estudo foram publicados na revista Cell Reports Physical Science.
