Novas publicações
A mutação do gene ARID1A torna os tumores sensíveis à imunoterapia
Última revisão: 02.07.2025

Todo o conteúdo do iLive é medicamente revisado ou verificado pelos fatos para garantir o máximo de precisão factual possível.
Temos diretrizes rigorosas de fornecimento e vinculamos apenas sites de mídia respeitáveis, instituições de pesquisa acadêmica e, sempre que possível, estudos médicos revisados por pares. Observe que os números entre parênteses ([1], [2], etc.) são links clicáveis para esses estudos.
Se você achar que algum dos nossos conteúdos é impreciso, desatualizado ou questionável, selecione-o e pressione Ctrl + Enter.
A imunoterapia revolucionou o tratamento do câncer nos últimos anos. Em vez de atingir os tumores diretamente, a imunoterapia direciona o sistema imunológico dos pacientes para atacá-los de forma mais eficaz. Isso é particularmente eficaz para alguns tipos de câncer difíceis de tratar. No entanto, menos da metade de todos os pacientes com câncer respondem às imunoterapias atuais, criando uma necessidade urgente de identificar biomarcadores que possam prever quais pacientes têm maior probabilidade de se beneficiar do tratamento.
Recentemente, cientistas notaram que pacientes cujos tumores têm uma mutação no gene ARID1A têm maior probabilidade de responder positivamente ao bloqueio do ponto de controle imunológico, um tipo de imunoterapia que funciona mantendo as células imunológicas que combatem o câncer ativadas.
Como a mutação do gene ARID1A está presente em muitos tipos de câncer, incluindo câncer de endométrio, ovário, colorretal, gástrico, hepático e pancreático, os pesquisadores do Salk Institute se perguntaram como ela poderia contribuir para a sensibilidade do tratamento e como os médicos poderiam usar essas informações para personalizar o tratamento do câncer para cada paciente.
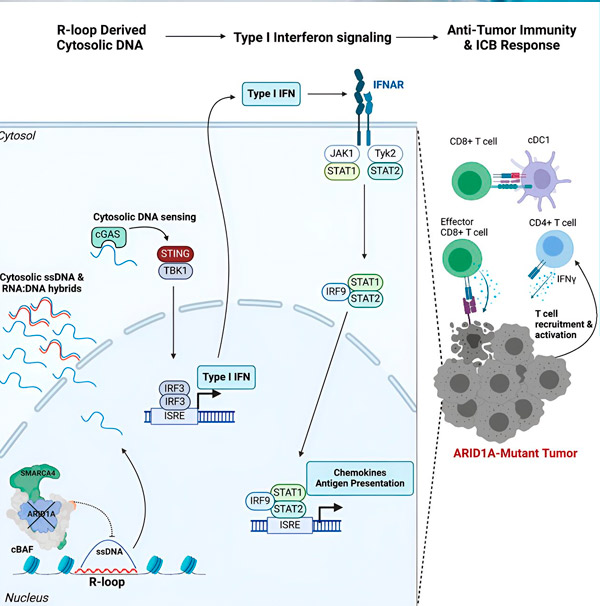
O novo estudo, publicado na revista Cell, mostra que a mutação ARID1A torna os tumores sensíveis à imunoterapia ao recrutar células imunes que combatem o câncer para o tumor por meio de uma resposta imune semelhante à antiviral.
Os pesquisadores sugerem que essa mutação e a resposta imune antiviral podem ser usadas como biomarcadores para melhor selecionar pacientes para imunoterapias específicas, como o bloqueio de pontos de controle imunológico. Essas descobertas também incentivam o desenvolvimento de medicamentos que tenham como alvo a ARID1A e proteínas relacionadas, a fim de tornar outros tumores mais sensíveis à imunoterapia.
"Isso pode realmente mudar o resultado do tratamento do câncer para os pacientes", disse a Professora Associada Diana Hargreaves, autora sênior do estudo. "Pacientes com a mutação ARID1A já têm uma resposta imunológica, então tudo o que precisamos fazer é reforçar essa resposta com o bloqueio do ponto de controle imunológico para ajudá-los a destruir seus tumores de dentro para fora."
Embora se soubesse que pessoas com mutações no gene ARID1A respondiam bem ao bloqueio do ponto de controle imunológico, a conexão exata entre os dois ainda não estava clara. Para esclarecer o mecanismo, cientistas do Instituto Salk utilizaram modelos murinos de melanoma e câncer colorretal com a mutação ARID1A e ARID1A funcional.
Fonte: Cell (2024). DOI: 10.1016/j.cell.2024.04.025
A equipe observou uma resposta imune robusta em todos os modelos com a mutação ARID1A, mas não naqueles em que a ARID1A era funcional, reforçando a ideia de que a mutação ARID1A está de fato impulsionando essa resposta. Mas como isso funciona em nível molecular?
"Descobrimos que o ARID1A desempenha um papel importante no núcleo, mantendo a organização adequada do DNA", afirma Matthew Maxwell, primeiro autor do estudo e aluno de pós-graduação no laboratório de Hargreaves. "Sem o ARID1A funcional, o DNA livre pode ser excisado e liberado no citosol, ativando uma resposta imune antiviral desejável que pode ser potencializada pelo bloqueio do ponto de controle imunológico."
O gene ARID1A codifica uma proteína que ajuda a regular a forma do nosso DNA e a manter a estabilidade do genoma. Quando o ARID1A sofre mutação, ele desencadeia uma cadeia de eventos semelhante à de Rube Goldberg nas células cancerígenas.
Primeiro, a ausência de ARID1A funcional resulta na liberação de DNA no citosol. O DNA citosólico então ativa um sistema de alarme antiviral, a via cGAS-STING, pois nossas células estão adaptadas para marcar qualquer DNA no citosol como estranho, a fim de protegê-las contra infecções virais. Por fim, a via cGAS-STING ativa o sistema imunológico para recrutar células T para o tumor e ativá-las em células T especializadas em matar o câncer.
Em cada etapa, dependente da anterior, essa cadeia de eventos — mutação ARID1A, escape de DNA, alarme cGAS-STING, recrutamento de células T — leva a um aumento no número de células T que combatem o câncer no tumor. O bloqueio do ponto de controle imunológico pode então ser usado para garantir que essas células T permaneçam ativadas, aumentando sua capacidade de derrotar o câncer.
"Nossas descobertas fornecem um novo mecanismo molecular pelo qual uma mutação ARID1A pode contribuir para uma resposta imune antitumoral", afirma Hargreaves. "O interessante sobre essas descobertas é seu potencial translacional. Podemos usar mutações ARID1A para selecionar pacientes para bloqueio de pontos de controle imunológico, e agora vemos um mecanismo pelo qual medicamentos que inibem ARID1A ou seu complexo proteico podem ser usados para aprimorar ainda mais a imunoterapia em outros pacientes."
Ao descrever o mecanismo pelo qual o bloqueio do ponto de controle imunológico é mais eficaz em cânceres com mutação ARID1A, os pesquisadores fornecem aos médicos uma justificativa para priorizar essa imunoterapia em pacientes com mutação ARID1A. Essas descobertas representam um passo importante para a personalização do tratamento do câncer e inspiram o desenvolvimento de novas terapias que tenham como alvo o ARID1A e seu complexo proteico.
No futuro, a equipe do Salk Institute espera que suas descobertas melhorem os resultados do tratamento para pacientes com vários tipos de câncer associados a mutações ARID1A e pretende explorar essa tradução clínica em colaboração com a Universidade da Califórnia, em San Diego.
