Novas publicações
Proteína-chave identificada para prevenir a perda de massa óssea na osteoporose
Última revisão: 02.07.2025

Todo o conteúdo do iLive é medicamente revisado ou verificado pelos fatos para garantir o máximo de precisão factual possível.
Temos diretrizes rigorosas de fornecimento e vinculamos apenas sites de mídia respeitáveis, instituições de pesquisa acadêmica e, sempre que possível, estudos médicos revisados por pares. Observe que os números entre parênteses ([1], [2], etc.) são links clicáveis para esses estudos.
Se você achar que algum dos nossos conteúdos é impreciso, desatualizado ou questionável, selecione-o e pressione Ctrl + Enter.
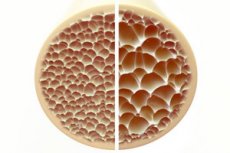
A osteoporose, uma condição caracterizada por ossos porosos e frágeis, representa uma ameaça significativa à saúde esquelética. Os ossos, como principal suporte estrutural do corpo humano, fornecem suporte vital. Quando a massa óssea diminui, não só prejudica esse suporte, como também a função geral, levando a uma diminuição da qualidade de vida.
À medida que a incidência de osteoporose aumenta na população idosa, há uma sobrecarga crescente nos recursos de saúde para cuidados de longo prazo. Portanto, é necessário compreender os mecanismos que contribuem para o desenvolvimento da osteoporose e desenvolver tratamentos direcionados eficazes para minimizar seu impacto a longo prazo.
Osteoblastos e osteoclastos são dois tipos de células que desempenham um papel fundamental na manutenção e remodelação do tecido ósseo. Enquanto os osteoblastos são células formadoras de osso responsáveis pela síntese e deposição de novo tecido ósseo, os osteoclastos são células degradadoras de osso, envolvidas na degradação e remoção de tecido ósseo antigo ou danificado.
Um aumento na proporção de osteoclastos leva à perda óssea em condições como osteoporose, artrite reumatoide (inflamação das articulações) e metástases ósseas (câncer que se espalhou para os ossos). Os osteoclastos surgem da diferenciação de macrófagos ou monócitos, que são tipos de células imunológicas.
Assim, a inibição da diferenciação dos osteoclastos pode servir como estratégia terapêutica para prevenir a perda óssea. No entanto, os mecanismos moleculares precisos que regulam o complexo processo de remodelação óssea permanecem obscuros.
Em um novo estudo, o Professor Tadayoshi Hayata, o Sr. Takuto Konno e a Sra. Hitomi Murachi, da Universidade de Ciências de Tóquio, juntamente com colegas, investigaram a regulação molecular da diferenciação dos osteoclastos. A estimulação com o ligante ativador do receptor do fator nuclear kappa B (RANKL) induz a diferenciação de macrófagos em osteoclastos.
Além disso, as vias de sinalização da proteína morfogenética óssea (BMP) e do fator de crescimento transformador (TGF-β) foram implicadas na regulação da diferenciação osteoclástica mediada por RANKL. No estudo atual, os pesquisadores buscaram investigar o papel da Ctdnep1, uma fosfatase (enzima que remove grupos fosfato) que suprime as vias de sinalização da BMP e do TGF-β.
O estudo foi publicado na revista Biochemical and Biophysical Research Communications.
O professor Hayata afirma: "O RANKL atua como um 'acelerador' para a diferenciação dos osteoclastos. Dirigir um carro requer não apenas um acelerador, mas também freios. Aqui, descobrimos que o Ctdnep1 atua como um 'freio' na diferenciação dos osteoclastos."
Os pesquisadores examinaram inicialmente a expressão de Ctdnep1 em macrófagos de camundongos tratados com RANKL e em células de controle não tratadas. Observaram que a expressão de Ctdnep1 não se alterou em resposta à estimulação com RANKL. No entanto, ela se localizou no citoplasma em forma granular nos macrófagos e se diferenciou em osteoclastos, diferentemente de sua localização perinuclear normal em outros tipos celulares, indicando sua função citoplasmática na diferenciação dos osteoclastos.
Além disso, a redução do Ctdnep1 (regulação negativa da expressão genética) resultou em um aumento no número de osteoclastos positivos para fosfatase ácida resistente a tartarato (TRAP), onde TRAP é um marcador de osteoclastos diferenciados.
A inativação de Ctdnep1 resultou no aumento da expressão de marcadores-chave de diferenciação, incluindo "Nfatc1", um fator de transcrição mestre induzido por RANKL para a diferenciação de osteoclastos. Esses resultados corroboram uma "função de freio" de Ctdnep1, que regula negativamente a diferenciação de osteoclastos. Além disso, a inativação de Ctdnep1 também resultou no aumento da absorção de fosfato de cálcio, sugerindo um papel supressor de Ctdnep1 na reabsorção óssea.
Por fim, embora a inibição da Ctdnep1 não tenha alterado a sinalização de BMP e TGF-β, as células deficientes em Ctdnep1 apresentaram níveis aumentados de proteínas fosforiladas (ativadas), que são produtos da via de sinalização RANKL. Esses resultados sugerem que o efeito inibitório da Ctdnep1 na diferenciação de osteoclastos pode não ser mediado pela sinalização de BMP e TGF-β, mas sim pela regulação negativa da via de sinalização RANKL e dos níveis da proteína Nfatc1.
No geral, esses resultados fornecem novos insights sobre o processo de diferenciação dos osteoclastos e identificam potenciais alvos terapêuticos que podem ser usados para desenvolver tratamentos que reduzam a perda óssea devido à hiperatividade dos osteoclastos. Além de doenças caracterizadas por perda óssea, a Ctdnep1 também foi identificada como um fator causal no meduloblastoma, um tumor cerebral infantil. Os autores estão otimistas de que sua pesquisa pode ser estendida a outras doenças humanas além do metabolismo ósseo.
O Professor Hayata conclui: "Nossos resultados sugerem que o Ctdnep1 é necessário para prevenir a osteoclastogênese excessiva. Esses resultados podem ampliar ainda mais nosso conhecimento sobre como a rede de fosforilação-desfosforilação controla a diferenciação dos osteoclastos e podem fornecer novas estratégias terapêuticas para o tratamento de doenças ósseas associadas à atividade excessiva dos osteoclastos."
