Novas publicações
O medicamento LM11A-31 atrasa a progressão da doença de Alzheimer num ensaio
Última revisão: 02.07.2025

Todo o conteúdo do iLive é medicamente revisado ou verificado pelos fatos para garantir o máximo de precisão factual possível.
Temos diretrizes rigorosas de fornecimento e vinculamos apenas sites de mídia respeitáveis, instituições de pesquisa acadêmica e, sempre que possível, estudos médicos revisados por pares. Observe que os números entre parênteses ([1], [2], etc.) são links clicáveis para esses estudos.
Se você achar que algum dos nossos conteúdos é impreciso, desatualizado ou questionável, selecione-o e pressione Ctrl + Enter.

Em um estudo recente publicado na revista Nature Medicine, cientistas conduziram um estudo de fase 2a, randomizado, duplo-cego e controlado por placebo para examinar a segurança e a eficácia do LM11A-31 no tratamento da doença de Alzheimer (DA) por meio da modulação do receptor de neurotrofina p75 (p75NTR).
A DA de início tardio é a forma mais comum de demência, caracterizada por insuficiência sináptica, degeneração e perda de células nervosas. Embora os dois principais medicamentos para o tratamento da DA visem o acúmulo de proteínas amiloide-β ou tau anormais, eles abordam apenas parte da fisiopatologia. Outra abordagem envolve o direcionamento de receptores e redes de sinalização que influenciam vias biológicas fundamentais. Estudos pré-clínicos mostram que a modulação do p75NTR com uma nova molécula química pequena, LM11A-31, reduz a perda sináptica causada por amiloide e tau anormal.
Descrição do estudo
Neste ensaio clínico randomizado, os pesquisadores examinaram se o LM11A-31 poderia retardar a progressão da doença de Alzheimer modulando o p75NTR em humanos.
Os participantes do estudo receberam cápsulas orais de LM11A-31 nas doses de 200 mg e 400 mg ou placebo na proporção de 1:1:1 para 242 pacientes com asma leve a moderada por 26 semanas. Os participantes tinham doença de Alzheimer biologicamente confirmada (nível de proteína β-amiloide 42 (Aβ42) no líquido cefalorraquidiano abaixo de 550 ng/L ou razão Aβ42:β40 abaixo de 0,89) diagnosticada de acordo com os critérios de McKhann, com pontuações no Mini-Exame Psiquiátrico (MEEM) de 18 a 26, pontuações na Escala de Depressão Geriátrica (EDG) abaixo de 5,0, pontuações na Escala Isquêmica de Hachinski modificada (EHI) ≤ 4,0, educação formal ≥ 8 anos e declínio cognitivo prévio ≥ 6 meses.
Os participantes elegíveis haviam tomado inibidores da acetilcolinesterase (IAChE) ou antagonistas parciais do receptor NMDA por ≥ 3 meses antes da entrada no estudo. Não faziam uso de drogas ilícitas, como antipsicóticos, benzodiazepínicos, antiepilépticos, sedativos, anti-hipertensivos de ação central, nootrópicos (exceto ginkgo biloba) ou analgésicos contendo opioides.
O desfecho primário do estudo foi a segurança e a tolerabilidade, avaliadas pela Escala de Avaliação de Gravidade de Pensamentos e Comportamentos Suicidas de Columbia (C-SSRS), sinais vitais, pressão arterial e parâmetros hematológicos. A ressonância magnética estrutural (RMC), a tomografia por emissão de pósitrons com fluorodesoxiglicose (FDG-PET) e biomarcadores do líquido cefalorraquidiano (LCR) foram utilizados para avaliar os desfechos cognitivos secundários. As medidas de DA incluíram tau fosforilada por Thr181, proteína tau total, Aβ40, Aβ42 e atividade da AChE. A equipe utilizou um teste neuropsicológico personalizado para avaliar os desfechos cognitivos secundários no início do estudo, nas semanas 12 e 26.
Resultados da pesquisa
O estudo concluiu que o LM11A-31 é seguro e bem tolerado, sem preocupações significativas com a segurança. Os eventos adversos mais comuns incluíram cefaleia, diarreia, eosinofilia e nasofaringite, sendo problemas gastrointestinais e eosinofilia os principais motivos para a descontinuação. Houve mais descontinuações no grupo de 400 mg em comparação com os grupos de 200 mg e placebo. A ressonância magnética não revelou preocupações com a segurança, incluindo anormalidades relacionadas à amiloide. Não houve diferenças significativas nos escores cognitivos ou nas anormalidades amiloides entre os dois grupos de tratamento.
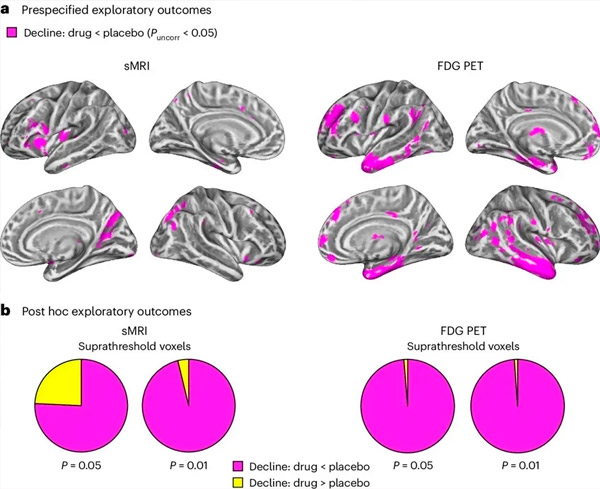
A. A análise de covariância de modelos mistos bidirecionais examinou interações entre tratamento (fármaco ou placebo) e tempo (pré ou pós-tratamento). Um contraste t unicaudal que examinou a hipótese de interação (fármaco retarda a progressão em comparação com placebo) mostrou que o tratamento com LM11A-31 retardou a degeneração longitudinal (painéis à esquerda) e o hipometabolismo da glicose (painéis à direita) no grupo do fármaco (cMRI, n = 127; PET, n = 121) em comparação com o grupo placebo (cMRI, n = 66; PET, n = 62). Voxels mostrando essa interação são mostrados em um limiar não corrigido de P < 0,05 (magenta) em uma superfície cortical específica da população. Os hemisférios esquerdo e direito são mostrados nas linhas superior e inferior, respectivamente. As regiões do cérebro mostrando interações inconsistentes com a hipótese são mostradas na Figura 7 nos Dados Suplementares.
B. Número total de voxels em regiões cerebrais DA vulneráveis predefinidas (área total dos gráficos de pizza) mostrando uma interação em linha com a hipótese (magenta) ou uma interação inconsistente com a hipótese (amarelo) em cada modalidade de imagem (cMRI, painel esquerdo; FDG PET, painel direito) em limiares cada vez mais liberais de P < 0,01 não corrigido e P < 0,05. Simulações de Monte Carlo mostraram que as proporções de voxels mostrando efeitos em linha com a hipótese versus inconsistentes com a hipótese foram significativamente maiores do que aquelas observadas com base em dados gerados aleatoriamente para cMRI e PET (P < 0,001 para cada modalidade; teste bicaudal).
O LM11A-31 reduziu efetivamente o aumento de Aβ42 e Aβ40 no LCR em comparação ao grupo placebo. O medicamento também demonstrou uma redução na variação percentual anual mediana do biomarcador proteico pré-sináptico SNAP25 e uma diminuição do biomarcador pós-sináptico NG, indicando uma desaceleração na perda de conexões pré-sinápticas e pós-sinápticas. O LM11A-31 também reduziu o aumento de YKL40, levando a uma diminuição nas pontuações do MMSE e a um aumento nas pontuações do ADAS-Cog-13. O medicamento também reduziu a perda de substância cinzenta no lobo frontal e no córtex parietal posterior e uma diminuição no metabolismo da glicose em áreas como o córtex entorrinal, o córtex temporal, o hipocampo, o córtex insular e o córtex pré-frontal.
Conclusão
O estudo concluiu que a modulação do p75NTR pelo LM11A-31 é adequada para ensaios clínicos maiores. O LM11A-31 atingiu o desfecho primário de segurança e foi bem tolerado em pacientes com DA leve a grave. Os resultados indicam a necessidade de estudos adicionais com durações de tratamento mais longas para avaliar o potencial de pequenas moléculas na regulação do p75NTR como terapia modificadora da doença na DA. O estudo demonstrou que o LM11A-31 afetou significativamente diversos biomarcadores, incluindo Aβ40, Aβ42, SNAP25, NG e YKL40, indicando uma desaceleração da progressão patológica. Estudos futuros podem avaliar indicadores adicionais da saúde glial.
