Novas publicações
Ativação da imunidade inata: uma parte importante do mecanismo identificado
Última revisão: 02.07.2025

Todo o conteúdo do iLive é medicamente revisado ou verificado pelos fatos para garantir o máximo de precisão factual possível.
Temos diretrizes rigorosas de fornecimento e vinculamos apenas sites de mídia respeitáveis, instituições de pesquisa acadêmica e, sempre que possível, estudos médicos revisados por pares. Observe que os números entre parênteses ([1], [2], etc.) são links clicáveis para esses estudos.
Se você achar que algum dos nossos conteúdos é impreciso, desatualizado ou questionável, selecione-o e pressione Ctrl + Enter.
Pesquisadores da LMU decifraram a interação complexa de várias enzimas em torno do receptor imune inato Toll-like 7 (TLR7), que desempenha um papel importante na proteção do nosso corpo contra vírus.
O receptor Toll-like 7 (TLR7), localizado nas células dendríticas do nosso sistema imunológico, desempenha um papel crucial na nossa defesa natural contra vírus. O TLR7 reconhece RNA viral de fita simples e outros RNAs estranhos e ativa a liberação de mediadores inflamatórios. Disfunções desse receptor também desempenham um papel fundamental em doenças autoimunes, tornando a compreensão e, idealmente, a modulação do mecanismo de ativação do TLR7 ainda mais importante.
Os pesquisadores, liderados pelo professor Veit Hornung e Marlene Berouti, do Centro de Genética de Munique e do Departamento de Bioquímica da LMU, conseguiram se aprofundar no complexo mecanismo de ativação. Estudos anteriores já demonstravam que moléculas complexas de RNA precisam ser cortadas para que o receptor as reconheça.
Utilizando uma gama de tecnologias, da biologia celular à microscopia crioeletrônica, pesquisadores da LMU descobriram como o RNA estranho de fita simples é processado para detectar o TLR7. O trabalho foi publicado na revista Immunity.
Numerosas enzimas estão envolvidas no reconhecimento de RNA estranho
Ao longo da evolução, o sistema imunológico se especializou em reconhecer patógenos por meio de seu material genético. Por exemplo, o receptor imune inato TLR7 é estimulado pelo RNA viral. Podemos pensar no RNA viral como longas cadeias de moléculas grandes demais para serem reconhecidas como ligantes do TLR7. É aí que entram as nucleases — ferramentas de corte molecular que cortam a "cadeia de RNA" em pequenos pedaços.
As endonucleases cortam as moléculas de RNA ao meio, como tesouras, enquanto as exonucleases clivam a fita de uma extremidade à outra. Esse processo gera diferentes fragmentos de RNA que agora podem se ligar a dois locais diferentes no receptor TLR7. Somente quando ambos os locais de ligação no receptor estão ocupados por esses pedaços de RNA é desencadeada uma cascata de sinalização que ativa a célula e dispara um estado de alarme.
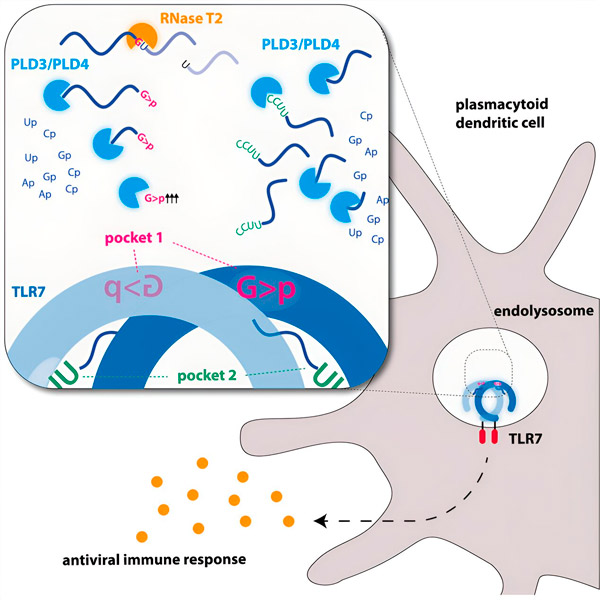
Imagem gráfica. Fonte: Immunity (2024). DOI: 10.1016/j.immuni.2024.04.010
Os pesquisadores descobriram que o reconhecimento do RNA do TLR7 requer a atividade da endonuclease RNase T2, atuando em conjunto com as exonucleases PLD3 e PLD4 (fosfolipase D3 e D4). "Embora se soubesse que essas enzimas podiam degradar o RNA", diz Hornung, "agora demonstramos que elas interagem com o TLR7 e, portanto, o ativam."
Equilibrando o sistema imunológico
Os pesquisadores também descobriram que as exonucleases de PLD desempenham um papel duplo nas células imunológicas. No caso do TLR7, elas têm um efeito pró-inflamatório, enquanto no caso de outro receptor de TLR, o TLR9, elas têm um efeito anti-inflamatório. "Esse papel duplo das exonucleases de PLD indica um equilíbrio perfeitamente coordenado para controlar as respostas imunológicas adequadas", explica Berouti.
"A estimulação e a inibição simultâneas da inflamação por essas enzimas podem servir como um importante mecanismo de proteção para prevenir disfunções no sistema." O papel que outras enzimas podem desempenhar nessa via de sinalização e se as moléculas envolvidas são adequadas como estruturas-alvo para terapia serão objeto de pesquisas futuras.
