Novas publicações
Como um embrião 'morde' o tecido materno: a mecânica da implantação em humanos filmada em tempo real pela primeira vez
Última revisão: 23.08.2025

Todo o conteúdo do iLive é medicamente revisado ou verificado pelos fatos para garantir o máximo de precisão factual possível.
Temos diretrizes rigorosas de fornecimento e vinculamos apenas sites de mídia respeitáveis, instituições de pesquisa acadêmica e, sempre que possível, estudos médicos revisados por pares. Observe que os números entre parênteses ([1], [2], etc.) são links clicáveis para esses estudos.
Se você achar que algum dos nossos conteúdos é impreciso, desatualizado ou questionável, selecione-o e pressione Ctrl + Enter.
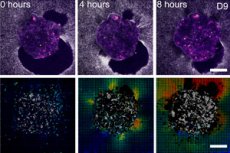
Cientistas de Barcelona (IBEC, Dexeus Mujer) e Tel Aviv demonstraram pela primeira vez, em tempo real e em 3D, como um embrião humano se fixa à "estrutura uterina" e, literalmente, puxa e reestrutura o tecido circundante. Para isso, criaram uma plataforma ex vivo deformável (géis de colágeno/MEC) e aplicaram microscopia de força de tração diretamente em embriões humanos e de camundongos vivos. A principal descoberta: o padrão de forças é específico da espécie, e os próprios embriões são mecanossensíveis: respondem a estímulos mecânicos externos reestruturando o citoesqueleto e alterando a orientação do crescimento.
Contexto do estudo
A implantação é o "gargalo" da reprodução humana: é nesta fase que tanto as concepções naturais quanto as tentativas de fertilização in vitro (FIV) frequentemente falham. Ao mesmo tempo, a implantação humana é intersticial: o embrião não se "adere" simplesmente, mas fica completamente inserido no endométrio – um processo bioquímica e mecanicamente complexo, mas até recentemente quase não observado em sistemas vivos em humanos. Portanto, a mecânica de adesão e invasão permaneceu uma "caixa-preta", e as conclusões eram frequentemente tiradas com base em marcadores indiretos ou dados de modelos animais.
A biologia clássica da implantação tem se baseado fortemente no camundongo, mas existem diferenças fundamentais entre as espécies, desde a orientação do blastocisto até a profundidade da implantação e o padrão das forças celulares. Em camundongos, a implantação é mais "superficial", com direções preferenciais de deslocamento do tecido; em humanos, é nitidamente invasiva, com forças de tração multifocais ao redor do embrião. Essas diferenças sugerem que o modelo do camundongo nem sempre se adapta aos humanos, especialmente no que diz respeito à mecânica. Observações diretas do embrião humano em um ambiente deformável eram necessárias.
O avanço tecnológico foi possível graças à combinação de matrizes 2D/3D deformáveis (colágeno/MEC) e microscopia de força de tração com imagens de alta frequência de longo prazo. Esse "útero artificial" tornou possível literalmente ver e medir como o embrião puxa, reestrutura e "perfura" o tecido circundante – e como ele responde a estímulos mecânicos externos (mecanossensibilidade). Isso abre caminho para novos critérios de avaliação do potencial de implantação e para o ajuste fino das condições de transferência de embriões.
O contexto é aplicado: se as propriedades mecânicas do ambiente e o padrão de forças embrionárias estão associados ao sucesso da implantação, então, na FIV, é possível selecionar propositalmente a rigidez/composição da matriz, levar em consideração as janelas de tempo de transferência e até mesmo usar métricas de "força" como um marcador de seleção adicional. Paralelamente, tais plataformas ajudarão a explicar a proporção de perdas gestacionais precoces, quando a bioquímica é "normal", mas a mecânica de adesão não. Tudo isso torna as observações diretas em 3D da implantação humana não apenas um belo vídeo, mas uma nova ferramenta para a medicina reprodutiva.
Por que isso é importante?
A falha de implantação é uma das principais causas de infertilidade e de até 60% dos abortos espontâneos. Apesar dos avanços bioquímicos na fertilização in vitro, a mecânica desse processo em humanos permaneceu uma "caixa-preta". Uma nova abordagem nos permite observar as forças e trajetórias da implantação embrionária e fornece uma base para aprimorar a seleção e as condições de transferência de embriões.
Como foi feito
Os pesquisadores montaram um "útero artificial" — um ambiente macio, transparente e deformável no qual uma matriz semelhante a um tecido se desloca visivelmente sob a influência de forças embrionárias. Em seguida, realizaram microscopia contínua e análise computacional dos deslocamentos das fibras.
- Plataformas 2D e 3D: em 3D, o embrião é imediatamente inserido na matriz (a etapa de fixação é “ignorada”), o que permite ver a perfuração na espessura do tecido.
- Alta "sobrevivência e penetração" em 3D: cerca de 80% de invasão bem-sucedida (limitada pela proximidade do vidro).
- Mapas de tração e correlação de volume digital mostram as amplitudes e direções dos deslocamentos ao redor do embrião — essencialmente uma "impressão" de força ao longo do tempo.
O que exatamente foi encontrado (resumidamente e ponto por ponto)
1) Mecânica de implantação específica da espécie
- Humano: o embrião é inserido na matriz, criando múltiplos focos de tração e formando deslocamentos radialmente uniformes ao seu redor; a profundidade de invasão é de até 200 µm.
- Camundongo: o embrião se espalha principalmente pela superfície com direções principais de deslocamento pronunciadas.
2) O embrião sente a mecânica do ambiente
- Forças externas → resposta: no embrião humano - recrutamento de miosina e pseudópodes celulares direcionados; no camundongo - rotação do eixo de implantação/crescimento em direção à fonte de força externa (orientação do eixo PD).
- Marcadores mecanossensíveis: no camundongo, mudanças na localização do YAP no trofoblasto; juntos, isso indica um circuito de feedback mecanossensível.
3) A relação entre força e sucesso da implantação
- Menor deslocamento de colágeno → pior progresso de implantação em embriões humanos.
- Integrinas - o "acoplador" da força: o bloqueio do peptídeo RGD/inibição de Src em camundongos reduz a profundidade/área de implantação.
Como é a implementação?
- Em plataformas 2D e 3D, um “halo” crescente de deslocamentos de fibras se forma ao redor do embrião; o mapa de tração pulsa como se o embrião estivesse “escaneando” seus arredores.
- No vidro, o embrião humano forma uma protuberância plana, mas em uma matriz macia ele permanece mais esférico e mais profundo - como em um tecido vivo.
O que isso traz para a prática (perspectivas para a fertilização in vitro e não só)
A ideia é simples: a implantação não envolve apenas a "química do receptor", mas também a mecânica de adesão e tração. Isso significa que podemos otimizar:
- Materiais e dureza média durante testes de potencial de cultura/implantação;
- Novos marcadores para seleção de embriões - baseados em trajetórias e amplitude de deslocamentos na matriz “inteligente”;
- Treinamento/modulação uterina (por exemplo, por meio de sinais mecânicos suaves) para melhorar a adesão sem intervenções agressivas.
Atenção: o trabalho ex vivo não ocorre "dentro do útero". Mas o próprio fato de um sinal mecânico externo alterar a orientação da implantação/organização dos eixos abre caminho para condições personalizadas de transferência de embriões.
Restrições
- O modelo ex vivo não leva em consideração a dinâmica imunológica, hormonal e vascular do endométrio real;
- Matrigel/colágeno definem um conjunto de propriedades (rigidez, viscoelasticidade, composição), sendo difícil alterá-las por um parâmetro;
- Restrições éticas para estudos em humanos (janela de até 14 dias) limitam a observação a longo prazo. No entanto, a alta concordância com os modos de implantação in vivo conhecidos (intersticial em humanos vs. superficial em camundongos) aumenta a confiança no modelo.
Conclusão
O embrião humano "puxa" e "perfura" ativamente seu caminho para dentro do tecido materno, e sinais mecânicos do ambiente podem reconfigurar seu comportamento. O padrão de forças e a estratégia de implantação são diferentes em humanos e camundongos — e isso pode explicar por que o modelo murino nem sempre prevê a implantação bem-sucedida em humanos. A mecânica é agora um ator de pleno direito na embriologia inicial e na medicina reprodutiva.
Fonte: Godeau AL et al. Força de tração e mecanosensibilidade mediam padrões de implantação específicos da espécie em embriões humanos e de camundongo. Science Advances 11(33): eadr5199 (15 de agosto de 2025). DOI: 10.1126/sciadv.adr519
