Médico especialista do artigo
Novas publicações
Síndrome do ovário poliquístico
Última revisão: 23.04.2024

Todo o conteúdo do iLive é medicamente revisado ou verificado pelos fatos para garantir o máximo de precisão factual possível.
Temos diretrizes rigorosas de fornecimento e vinculamos apenas sites de mídia respeitáveis, instituições de pesquisa acadêmica e, sempre que possível, estudos médicos revisados por pares. Observe que os números entre parênteses ([1], [2], etc.) são links clicáveis para esses estudos.
Se você achar que algum dos nossos conteúdos é impreciso, desatualizado ou questionável, selecione-o e pressione Ctrl + Enter.
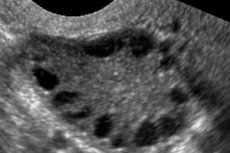
A síndrome do ovário policístico é uma patologia heterogênea multifatorial caracterizada por irregularidades no ciclo menstrual, anovulação crônica, hiperandrogenia, alterações nos ovários císticos e infertilidade. A síndrome do ovário policístico é caracterizada por obesidade moderada, mensal ou amenorréia irregular e sintomas de excesso de andrógenos (hirsutismo, acne). Normalmente, os ovários contêm muitos cistos. O diagnóstico é baseado em testes de gravidez, níveis hormonais e exame para excluir tumores virilizantes. O tratamento é sintomático.
Causas síndrome do Ovário Poliquístico
A síndrome do ovário poliquístico é uma patologia endócrina comum do sistema reprodutivo, ocorrendo em 5-10% dos pacientes; caracterizada pela presença de anovulação e um excesso de andrógenos de uma etiologia pouco clara. Os ovários podem ser de tamanho normal ou ampliados, com uma cápsula lisa e espessada. Como regra geral, os ovários contêm muitas pequenas escovas foliculares de 26 mm de espessura; Às vezes, existem grandes cistos contendo células atretic. Observa-se um aumento nos níveis de estrogênio, o que leva a um risco aumentado de hiperplasia endometrial e, finalmente, câncer de endometrio. Muitas vezes, há um aumento nos níveis de andrógenos, o que aumenta o risco de síndrome metabólica e hirsutismo.
 [13]
[13]
Patogênese
As mulheres com síndrome do ovário policístico (PCOS) apresentam anormalidades no metabolismo dos andrógenos e dos estrogênios, a síntese quebrada dos andrógenos. A doença é acompanhada por altas concentrações no soro de hormônios androgênicos, como testosterona, androstenediona, sulfato de dehidroepiandrosterona e (DHEA-S). Contudo, os níveis normais de andrógenos podem às vezes ser determinados.
A PCOS também está associada à resistência à insulina, hiperinsulinemia e obesidade. A hiperinsulinemia também pode levar à supressão da síntese de SHBG, que, por sua vez, pode melhorar os sinais de androgenismo.
Além disso, a resistência à insulina na síndrome do ovário policístico está associada à adiponectina, um hormônio secretado por adipócitos, que regula o metabolismo lipídico e os níveis de glicose no sangue.
Os níveis elevados de andrógenos são acompanhados por um aumento no efeito estimulante do hormônio luteinizante (LH), secretado pela glândula pituitária anterior, o que leva a um aumento no fluxo de células do ovário. Essas células, por sua vez, aumentam a síntese de andrógenos (testosterona, androstenediona). Devido ao baixo nível de hormônio folículo-estimulante (FSH) em relação à LH, as células granulares do ovário não podem aromatizar andrógenos em estrogênios, o que leva a uma diminuição no nível de estrogênios e subsequente anovulação.
Algumas evidências sugerem que os pacientes têm uma desordem funcional do citocromo P450c17, 17-hidroxilase, que inibe a biossíntese de andrógenos.
A síndrome dos ovários policísticos é uma síndrome geneticamente heterogênea. Estudos de membros da família com PCOS provam herança autossômica dominante. Uma ligação genética entre PCOS e obesidade foi recentemente confirmada. Gene variante FTO (rs9939609, que predispõe para a obesidade geral) está significativamente associado com a susceptibilidade ao desenvolvimento polimorfismos SPKYa.Byli locus de 2p16 identificados (2p16.3, 2p21 e 9q33.3), que está associada com a síndrome do ovário policístico, bem como o gene que codifica o receptor de hormônio luteinizante (LH) e gonadotropina coriónica (HG).
Sintomas síndrome do Ovário Poliquístico
Sintomas da síndrome de ovários policísticos aparecem durante a puberdade, a manifestação deles diminui com o tempo. A presença de menstruação regular por algum tempo após a menarca exclui o diagnóstico de síndrome do ovário policístico. Durante o exame, geralmente há muco cervical abundante (isto reflete altos níveis de estrogênio). O diagnóstico de síndrome de ovário policístico pode ser suspeitado se uma mulher tiver pelo menos dois sintomas típicos (obesidade moderada, hirsutismo, menstruação irregular ou amenorréia).
A combinação mais comum dos seguintes sintomas clínicos:
- violação do ciclo menstrual (oligomenorréia, hemorragia uterina disfuncional, amenorréia secundária);
- anovulação;
- infertilidade;
- girsutizm;
- violação do metabolismo da gordura (obesidade e síndrome metabólica);
- diabetes;
- síndrome da apneia obstrutiva do sono.
O que está incomodando você?
Diagnósticos síndrome do Ovário Poliquístico
O diagnóstico é baseado na exclusão da gravidez (teste de gravidez), bem como no estudo de estradiol, FSH, TSH e prolactina no soro. O diagnóstico é confirmado pela ultra-sonografia, que revela mais de 10 folículos no ovário; Os folículos costumam ocorrer na periferia e se assemelham a uma série de pérolas. Se houver presença de folículos nos ovários e hirsutismo, é necessário determinar os níveis de testosterona e DHEAS. Os níveis patológicos são avaliados como na amenorréia.

 [23], [24], [25], [26], [27], [28]
[23], [24], [25], [26], [27], [28]
Anamnese e exame físico
Realizando uma cuidadosa coleção de anamnese, os fatores hereditários do desenvolvimento da síndrome de ovários policísticos são revelados. Ao exame, o índice de massa corporal e a proporção da circunferência da cintura para a circunferência do quadril (na norma ≤ 0,8) são calculados para o diagnóstico de excesso de peso corporal e obesidade.
A síndrome dos ovários policísticos caracteriza-se por polimorfismo de sinais clínicos e laboratoriais.
Métodos especiais para o diagnóstico de síndrome de ovário poliquístico
Certifique-se de realizar um exame hormonal no 3-5º dia das reações menstruais: no sangue determinar o nível de LH, FSH, prolactina, testosterona, andrógenos adrenais - DHEAS, 17-hidroxiprogesterona. A síndrome do ovário policístico caracteriza-se por um alto índice de LH / FSH -> 2,5-3 (devido ao aumento dos níveis de LH) e hiperandrogenismo.
De modo a clarificar a origem de hiperandrogenismo o teste de estimulação de ACTH é levada a cabo para o diagnóstico diferencial com hiperandrogenismo causado pela mutação do gene que codifica para a enzima 21-hidroxilase nas glândulas supra-renais (diagnóstico apagados e formas latentes síndrome adrenogenital). Técnica de: a 9:00 produzir amostras de sangue a partir da veia cubital, em seguida injectada por via intramuscular de 1 mg do depósito de droga sinakten após 9 h - repetido amostragem de sangue. Em ambas as porções, a concentração de cortisol no sangue e 17 oksiprogesterona mais fórmula calculada valor especial coeficiente que não deve exceder 0,069. Nestes casos, a amostra é negativa e a mulher (ou homem) não é portador da mutação do gene da 21-hidroxilase.
Uma amostra com difenina é usada para detectar formas centrais de ovário policístico e a possibilidade de tratamento com drogas de neurotransmissor. Técnica de amostra: a concentração inicial de LH e testosterona é determinada no sangue, em seguida, a difenina é tomada 1 comprimido 3 vezes ao dia durante 3 dias, após o que a concentração desses mesmos hormônios é determinada repetidamente no sangue. A amostra é considerada positiva se o nível de LH e testosterona diminuir.
- Com ultra-som dos órgãos genitais, ovários alargados (10 cm 3 ou mais), são determinados vários folículos de até 9 mm de diâmetro, consolidação do estroma ovariano e espessamento da cápsula.

- Além disso, se suspeita de resistência à insulina, é realizado um teste de tolerância à glicose para determinar o nível de insulina e glicose antes e depois da carga.
- Se for recomendada uma suspeita de gênese adrenal da síndrome do ovário policístico, é recomendável o aconselhamento genético e a genotipagem HLA.
- Histerosalpingografia.
- Laparoscopia.
- Avaliação da fertilidade do esperma do cônjuge.
Em novembro de 2015, a Associação Americana de Endocrinologia Clínica (AACE), o Colégio Americano de Endocrinologia (ACE) e a Sociedade para o Estudo da Redução de Andrógenos e SOP (AES) lançaram novas recomendações no diagnóstico de SOP. Essas recomendações são:
- Os critérios diagnósticos de PCOS devem incluir um dos seguintes três critérios: anovulação crônica, hiperandrogenismo clínico e poliquismo de ovário policístico.
- Além dos achados clínicos, o nível de 17-hidroxiprogesterona e hormônio anti-hormônio no soro deve ser determinado para o diagnóstico de SOP.
- A análise do nível de testosterona livre é mais sensível à determinação de um excesso de andrógenos do que o nível de testosterona total.
O que precisa examinar?
Quem contactar?
Tratamento síndrome do Ovário Poliquístico
As mulheres que têm observado anovulatórios ciclos menstruais (ou nenhuma história menstruação irregular e não há sinais de produção de progesterona), na ausência de hirsutismo e falta de vontade de engravidar, administrado progestina intermitente (por exemplo, medroxiprogesterona 5-10 mg por via oral uma vez por dia durante 10 14 dias de cada mês durante 12 meses) ou contraceptivos orais para reduzir o risco de hiperplasia do endométrio e cancro, e reduzir o nível de androgénios circulantes.
Mulheres que sofrem de síndrome de ovário policístico com ciclos anovulatórios, com hirsutismo e que não planejam gravidez, o tratamento visa reduzir o hirsutismo e regular os níveis de testosterona e DHEAS no soro. As mulheres que querem engravidar são tratadas por infertilidade.
O tratamento da infertilidade na síndrome de ovários policísticos é realizado em 2 estágios:
- 1º estágio - preparatório;
- O segundo estágio é a estimulação da ovulação.
A terapia no estágio preparatório depende da forma clínica e patogenética da síndrome do ovário policístico.
- Na síndrome de ovários poliquísticos e obesidade, a consulta de medicamentos que contribuem para a redução da resistência à insulina é indicada: a droga de escolha, metformina, é administrada por via oral 500 mg 3 vezes ao dia por 3-6 meses.
- Na forma ovariana da síndrome do ovário policístico e níveis elevados de LH, são utilizados medicamentos que reduzem a sensibilidade do sistema hipotálamo-hipofisário para completar a supressão da função ovariana (nível de estradiol no soro <70 pmol / L):
- Buserelin spray, 150 mcg em cada narina 3 vezes por dia a partir do dia 21 ou 2 do ciclo menstrual, o curso é de 1-3 meses, ou
- Depósito de Buserelin em / m 3,75 mg uma vez a cada 28 dias a partir do 21º ou 2º dia do ciclo menstrual, o curso é de 1-3 meses ou
- leuprorelina n / c 3,75 mg 1 vez por 28 dias a partir do 21º ou 2º dia do ciclo menstrual, curso de 1-3 meses ou
- tryptorelin n / k 3,75 mg uma vez em 28 dias ou 0,1 mg uma vez por dia a partir do 21º ou 2º dia do ciclo menstrual, o curso 1-3 meses.
Não tem importância fundamental sobre o qual (o 21º ou o 2º) dia do ciclo menstrual para nomear agonistas de GnRH, no entanto, a nomeação a partir do 21º dia é preferível, uma vez que, neste caso, não são formados cistos ovarianos. Quando administrado a partir do 2º dia do ciclo, a fase de ativação que precede a fase de supressão no mecanismo de ação do agonista de GnRH coincide com a fase folicular do ciclo e pode causar a formação de cistos ovarianos.
Preparativos alternativos:
- etinil estradiol / dienogest intraperitonealmente 30 μg / 2 mg uma vez ao dia do 5º ao 25º dia do ciclo menstrual, curso 3-6 meses ou
- acetato de etinil estradiol / ciproterona dentro de 35 μg / 2 mg uma vez ao dia do 5º ao 25º dia do ciclo menstrual, o curso 3-6 meses.
- Com a forma adrenal da síndrome de ovários policísticos, a consulta dos medicamentos com glicocorticóides é indicada:
- Dexametasona dentro de 0,25-1 mg uma vez por dia, curso 3-6 meses, ou
- metilprednisolona dentro de 2-8 mg uma vez por dia, curso 3-6 meses, ou
- prednisolona 2,5-10 mg uma vez por dia, o curso de 3-6 meses.
- Com a forma central da síndrome de ovários policísticos são utilizados anticonvulsivantes:
- difenina 1 comprimido 1-2 vezes ao dia;
- carbamazepina oral por 100 mg 2 vezes por dia, o curso 3-6 meses.
No segundo estágio, a ovulação é estimulada.
A escolha das preparações e os regimes para sua administração são determinados levando em consideração os dados clínicos e laboratoriais. Durante a indução da ovulação, é realizado um ultra-som completo e monitorização hormonal do ciclo estimulado.
É inaceitável conduzir a indução de ovulação com qualquer medicação sem monitoramento de ultra-som. Não é apropriado iniciar a indução de ovulação com formações císticas nos ovários> 15 mm de diâmetro e a espessura do endométrio> 5 mm.
A indução da ovulação com clomifeno é apresentada, brevemente, história de doença em mulheres jovens com níveis suficientes de estrogénio (estradiol no soro <150 pmol / L), e baixos níveis de LH (> 15 UI / L).
O clomifeno é administrado por via oral 100 mg uma vez ao dia do dia 5 ao 9 do ciclo menstrual na mesma hora do dia.
O ultra-som de controle é realizado no 10º dia do ciclo, avaliando-se o diâmetro do folículo dominante e a espessura do endométrio. Os exames são realizados todos os dias, no período do período, diariamente. Não importa o dia do ciclo, mas o tamanho do folículo de liderança: se seu diâmetro for superior a 16 mm, então é necessário realizar um ultra-som todos os dias até atingir um tamanho de 20 mm.
Regimes de tratamento alternativo (com efeito antiestrogênico pronunciado):
Esquema 1:
- clomifeno dentro de 100 mg uma vez ao dia do 5º ao 9º dia do ciclo menstrual na mesma hora do dia +
- etinil estradiol (EE) por via oral 50 μg duas vezes ao dia do dia 10 ao 15 do ciclo menstrual ou
- Estradiol dentro de 2 mg duas vezes ao dia, do 10º ao 15º dia do ciclo menstrual.
Esquema 2:
- clomifeno dentro de 100 mg uma vez ao dia do 3º ao 7º dia do ciclo menstrual na mesma hora do dia +
- menotropinas em / m 75-150 UI, uma vez ao dia, ao mesmo tempo do 7º ao 8º dia do ciclo menstrual ou
- Follitropina alfa IM 75-150 UI, uma vez ao dia, ao mesmo tempo, do 7º ao 8º dia do ciclo menstrual.
A indução de ovulação de clomifeno por citrato não é indicada nas seguintes situações:
- quando a hipoestrogênio (nível sérico de estradiol <150 pmol / l);
- após a preparação preliminar por agonistas de GnRH (a hipoestrogenia se desenvolve como resultado da diminuição da sensibilidade do sistema hipotálamo-hipófise-ovário);
- em mulheres de maior idade reprodutiva, com uma longa história da doença e um alto nível de LH no soro sanguíneo (> 15 UI / L). Não é aconselhável aumentar a dose de clomifeno a 150 mg / dia com ciclos repetidos de estimulação, à medida que o efeito antiestrogênico periférico negativo se intensifica.
Não recomenda mais de 3 cursos de estimulação com clomifeno; Se o tratamento for ineficaz, as gonadotropinas devem ser usadas.
A estimulação da ovulação por gonadotropinas é indicada na ausência de foliculogênese adequada após a estimulação com clomifeno, na presença de efeito antiestrogênico periférico pronunciado, saturação insuficiente de estrogênio. Pode ser realizada em pacientes jovens, bem como em idade reprodutiva tardia.
Drogas de escolha:
- menotropinas em / m 150-225 UI uma vez por dia a partir do 3-5º dia do ciclo menstrual ao mesmo tempo, o curso é de 7-15 dias ou
- urofollitropina em / m 150-225 IU uma vez por dia a partir do 3-5º dia do ciclo menstrual ao mesmo tempo, o curso é de 7-15 dias.
Medicamentos alternativos (com alto risco de síndrome de hiperestimulação ovárica):
- folitropina alfa / m de 100-150 UI de uma vez por dia com um ciclo menstrual de 3-5 dias, ao mesmo tempo, a taxa de 15/07 sut.Induktsiya ovulação com gonadotrof inas que utilizam análogos da GnRH é mostrado na presença de síndrome do ovário policístico com alta nível de LH no soro sanguíneo (> 15 UI / l).
Drogas de escolha:
- Buserelin na forma de um spray de 150 mcg em cada narina 3 vezes ao dia a partir do 21º dia do ciclo menstrual ou
- buserelin depot em / m 3,75 mg uma vez no 21º dia do ciclo menstrual;
- leuprorelina n / k 3,75 mg uma vez no 21º dia do ciclo menstrual;
- tryptorelin n / k 3,75 mg uma vez no 21º dia do ciclo menstrual ou 0,1 mg uma vez por dia a partir do 21º dia do ciclo menstrual +
- Menotropinum m / m 225-300 UI uma vez por dia a partir do 2-3º dia do próximo ciclo menstrual ao mesmo tempo.
Medicamentos alternativos (com alto risco de síndrome de hiperestimulação ovárica):
- menotropinas em / m 150-225 IU uma vez por dia a partir do 2-3º dia do ciclo menstrual ao mesmo tempo ou
- folitropina alfa v / m 150-225 IU uma vez ao dia do 2º ao 3º dia do ciclo menstrual ao mesmo tempo +
- ganirelix n / k 0,25 mg uma vez por dia, a partir do 5º-7º dia de gonadotropinas (quando atinge o tamanho do folículo dominante de 13-14 mm);
- cetrorelix n / k 0,25 mg uma vez por dia, começando com o 5-7º dia do uso de gonadotropina (quando atinge o tamanho do folículo dominante de 13-14 mm).
Indução da ovulação em pacientes de idade reprodutiva tardia (com fraca resposta ovariana a drogas gonadotrópicas).
Drogas de escolha:
- menotropinas em / m 225 UI uma vez por dia a partir do 3-5º dia do ciclo menstrual ao mesmo tempo +
- tryptorelin n / k 0,1 mg uma vez por dia a partir do 2º dia do ciclo menstrual.
Preparativos alternativos:
- tryptorelin n / k 0,1 mg uma vez por dia a partir do 2º dia do ciclo menstrual +
- folitropina alfa v / m 200-225 IU uma vez por dia a partir do 3-5º dia do ciclo menstrual ao mesmo tempo.
Em todos os esquemas com o uso de gonadotropinas, a adequação da dose do último é estimada pela dinâmica do crescimento folicular (a uma taxa de 2 mm / dia). Com o crescimento lento dos folículos, a dose é aumentada em 75 UI, com um crescimento muito rápido diminui em 75 UI.
Em todos os esquemas, na presença de um folículo maduro de 18 a 20 mm de tamanho, a espessura do endométrio não é inferior a 8 mm, a terapia é interrompida e o IM coriónico de gonadotropina recebe 10 000 unidades uma vez.
Após a ovulação ser estabelecida, a fase lútea do ciclo é suportada.
Drogas de escolha:
- Dydrogesterona por via oral 10 mg 1 a 3 vezes por dia, curso 10-12 dias ou
- progesterona no interior por 100 mg 2-3 vezes por dia, ou na vagina 100 mg 2-3 vezes por dia, ou em / m 250 mg uma vez por dia, o curso 10-12 dias. Medicamento alternativo (na ausência de sintomas de hiperestimulação ovariana):
- gonadotropina coriônica em / m 1500-2500 unidades 1 vez por dia durante 3,5 e 7 dias da fase lútea.
Outras drogas utilizadas no tratamento de SOP:
- Antiandrogénios (por exemplo, espironolactona, leuprolide, finasterida).
- Drogas que reduzem o açúcar (por exemplo, metformina, insulina).
- Moduladores seletivos de receptores de estrogênio (por exemplo, citrato de clomifeno).
- Drogas para o tratamento da acne (por exemplo, peróxido de benzoíla, creme de tretinoína (0,02-0,1%) / gel (0,01-0,1%) / solução (0,05%), creme de adapaleno (0,1% ) / gel (0,1%, 0,3%) / solução (0,1%), eritromicina 2%, clindamicina 1%, Sulfametamida de sódio 10%).
Efeitos colaterais do tratamento
Quando o clomifeno é utilizado, a maioria dos pacientes desenvolve um efeito antiestrogênico periférico, que consiste em atrasar o crescimento do endométrio pelo crescimento do folículo e reduzir a quantidade de muco cervical. Na utilização de gonadotrofinas, gonadotropina da menopausa humana, especialmente (menotropiny) podem desenvolver síndrome do ovário hiperestimulação (OHSS), com a utilização de FSH recombinante (folitropina), o risco de síndroma de hiperestimulação ovárica menos. Quando se utiliza esquemas que envolvem agonista de GnRH (triptorelina, buserelina, leuprorelina), o risco de síndroma de hiperestimulação ovárica é aumentada, e o uso de agonistas de GnRH podem causar sintomas de deficiência de estrogénio - afrontamentos, pele seca e membranas mucosas.
Previsão
A eficácia do tratamento da infertilidade na síndrome dos ovários policísticos depende das características clínicas e hormonais do curso da doença, da idade da mulher, da adequação da terapia preparatória, da correção da seleção do esquema de indução da ovulação.
Em 30% das mulheres jovens com uma curta história da doença, é possível realizar uma gravidez após o pré-tratamento sem indução da ovulação.
A eficácia da estimulação da ovulação com clomifeno não excede 30% por mulher, 40% dos pacientes com síndrome do ovário policístico são resistentes ao clomifeno.
O uso de menotropinas e urofollitropina permite que a gravidez seja alcançada em 45-50% das mulheres, mas essas drogas aumentam o risco de síndrome de hiperestimulação ovárica.
Os esquemas mais eficazes são o uso de agonistas de GnRH, que permitem evitar picos de LH "parasitas": até 60% das gestações por 1 mulher. No entanto, quando se utilizam estas drogas, observa-se o maior risco de complicações - formas graves de síndrome de hiperestimulação ovárica, gravidezes múltiplas. O uso de antagonistas de GnRH não é menos efetivo, mas não está associado a um alto risco de síndrome de hiperestimulação ovárica.
 [34]
[34]

